已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________________ _________。
(2)C的氢化物分子是 (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非
极性溶剂。据此可判断E(CO)5的晶体类型为 ;E(CO)5在一定条件下发生分解反应:E (CO)5 ="=" E (s) + 5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
则: 体心立方晶胞和面心立方晶胞的棱长之比为: 。(保留比例式,不要求计算结果)
在1×105Pa和298K时,将拆开1mol共价键 所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
| 共价键 |
H-H |
N≡N |
N-H |
| 键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反 应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是()
A. Q1>Q2 B. Q1<Q 2 C. Q1=Q2
2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达 到化学平衡时,正反应和逆反应的速率都为零。
到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D. k反应达到平衡状态,最多可生成氨2 mol。
E. 工业 合成氨,我们希望提高反应物的转化率并加快反应速率。
合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示。(体积变化忽略不计)
(1)X、Y的物质的量浓度 之比为
之比为
(2)盐酸的物质的量浓度为
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属质 量/g |
金属状态 |
C(H2SO4) /mol・L-1[[] |
V(H2SO4)/mL |
溶液温度/℃ |
金属消 失的时间/s 失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
2 0 0 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
 250 250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
分析上述数据,回答下列问题:
(1)实验4和5表明:,反应速率越快;
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: _________
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)==1.8×10-10,Ksp(AgY)==1.0×10-12,Ksp(AgZ)==8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(以被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为: _______________
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)由上述Ksp判断,在上述(2)的体系中,能否实现AgY向AgZ的转化,并简述理由: _______
氢氧化钾是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如
图所示。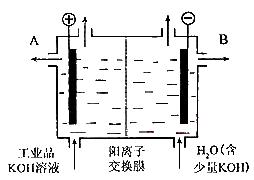
(1)该电解槽的阳极反应式是。
(2)除去杂质后得氢氧化钾溶液从液体出口(填写“A”或“B”)导出。