计算题:
已知:晶体“二氧化硅”可由晶体“硅”衍生得到;下图是晶体“硅”及“二氧化硅”的晶胞示意图:
试回答:
(1)请写出SiO2晶体的两种主要用途:
(2)请写出与晶体SiO2化学键及晶体类型完全相同的两种物质的名称:
(3)已知:二氧化硅晶体的密度为ρg/cm3 , 试求二氧化硅晶体中最近的两个Si原子之间的距离的表达式?(保留原表达式,不用化简)
[化学——选修3:物质结构与性质](15分)氮元素可以形成多种化合物。回答以下问题:
(1)①NH3分子的空间构型是_______________;
②化合物NF3为分子(填“极性”或“非极性”),若其沸点为-129 ℃,则其晶体类型为。
(2)已知尿素的结构式为: ,
,
①基态氮原子的价电子排布图是_________________。
②其中C、N、O三种元素的电负性由大到小顺序是。
③尿素分子中C和N原子的杂化方式分别是、。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子的电子式为___________。
②肼可用作火箭燃料, 肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在(填标号)
a.离子键b.共价键c.配位键 d.范德华力
X~R是元素周期表中的短周期元素,其性质或结构信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 性质 信息 |
能形成+7价的化合物 |
日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
位于第IVA,是形成化合物种类最多的元素 |
请用化学用语回答下列问题:
(1)X在元素周期表中的位置是_________________________。
(2)元素W的离子结构示意图为_______________________。
(3)元素R的最高价氧化物的电子式为_________________。
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为①,②。
(5)含Y的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是。(用离子方程式表示)
(6)W的氢氧化物是重要的基本化工原料。写出工业上制取该氢氧化物的离子反应方程式。
(一)写出下列物质在水溶液中的电离方程式:
(1)NH4NO3
(2)NaHSO4.
(二)写出下列反应的离子方程式:
(1)用稀硫酸清除铁锈:
(2)硫酸铜溶液和氢氧化钡溶液:
(三)配平下列离子方程式:
(1)______ Fe(OH)3+______ ClO-+______ OH-→ ______ FeO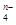 +______ Cl-+______ H2O。
+______ Cl-+______ H2O。
(2)已知反应中ClO-与OH-的物质的量之比为3∶4,则n=______,此时转移电子的物质的量为_____。
(3)根据前面的知识,推测FeO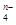 能和下列________(填字母)物质反应。
能和下列________(填字母)物质反应。
| A.O2 | B.SO2 | C.H2S | D.HClO |
[有机化学基础]
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: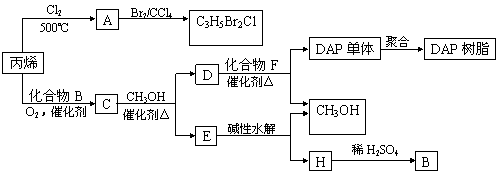
已知酯与醇可发生如下酯交换反应: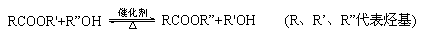
(1)农药分子C3H5Br2Cl中每个碳原子上均连有卤原子。
①A的结构简式是;
②由丙烯生成A的反应类型是。
(2)A水解可得到D,该水解反应的化学方程式是
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是。
(4)下列说法正确的是(选填序号字母)。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是。
(选考)A.[物质结构与性质]
2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下: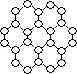
(1)下列有关石墨烯说法正确的是;
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含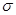 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
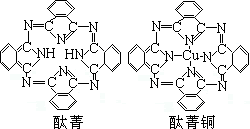
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为 __________;
②乙醇沸点比氯乙烷高,主要原因是______________________;
③金与铜可形成的金属互化物合金(如图),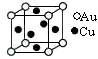 它的化学式可表示为;
它的化学式可表示为;
④下列分子属于非极性分子的是;
a.甲烷b.乙炔 c.苯d.乙醇
⑤酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是;酞菁铜分子中心原子的配位数为。