[有机化学基础]
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂: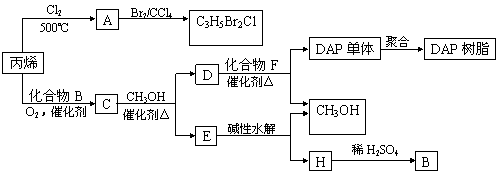
已知酯与醇可发生如下酯交换反应: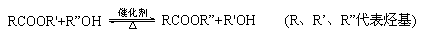
(1)农药分子C3H5Br2Cl中每个碳原子上均连有卤原子。
①A的结构简式是 ;
②由丙烯生成A的反应类型是 。
(2)A水解可得到D,该水解反应的化学方程式是
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是 。
(4)下列说法正确的是(选填序号字母) 。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是 。
(6)F的分子式为C10H10O4。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是 。
短周期的四种元素W、X、Y、Z,原子序数依次变小,四种元素的原子核外电子层数之和为8。X元素的原子最外层电子数等于Y和Z两元素的原子最外层电子数之和。W元素和Y元素的原子最外层上的电子数分别是各自电子层数的2倍。X和Z可以形成XZ3的化合物。
(1)写出元素名称:W__________,X____________,Y__________,Z__________。
(2)(XZ4)2W属于离子化合物,写出此化合物的电子式_________________。
(3)A物质是一种酸,它的一个分子里含有一个W原子,一个X原子,一个Y原子和一个Z原子, A物质的钾盐溶液常用检验___________(填写一种阳离子符号)。
(4)已知W、X、Y、Z四种元素可两两组成多种气态分子,其中两种可相互反应,且因量的不同而产物也不同,请写出其不同反应的化学方程式:①__________________________;
②___________________________________________________________________________。
(5)已知W、X、Y、Z四种元素可两两组成多种微粒,请写出其中所含电子数相同的任意三种微粒______________________________________。
下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
| 4 |
⑩ |
(1)在①~⑩元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是,呈两性的是。写出在水溶液中三者之间相互反应的离子方程式:,
,
。
用铜、银与硝酸银设计一个原电池,此电池的负极是:,
负极的电极反应式是:,
总反应方程式为。
在水溶液中,YO3-与S2-发生反应的离子方程式:YO3-+3S2-+6H+=Y-+3S↓+3H2O。请回答:
(1)YO3—中Y的化合价是_______。
(2)Y元素原子的最外层电子数是_______,它可能处于第_______族。
下图是元素周期表的前四周期的结构,请回答
| A |
|||||||||||||||||
| B |
C |
D |
|||||||||||||||
| E |
F |
G |
|||||||||||||||
| H |
|||||||||||||||||
⑴请写出各元素的元素符号:A、B、C、D、
⑵请写出C元素单质的结构式
⑶E、D两种元素可形成一种原子个数比为1:1的化合物M,请写出M的电子式,指出化合物M中的化学键类型。
⑷E、F、G三种元素的最高价氧化物对应的水化物可以两两反应,请写出反应的离子方程式:
E+F
E+G
F+G
⑸H的一种氢氧化物不稳定,很容易被氧气氧化,请写出该反应的化学方程式: