可逆反应A(g) +3B(g)==2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是
| A.VA=0·15mol/(L·min) | B.VB=0·6mol/(L·min) |
| C.VC=0·4mol/(L·min) | D.VD=0·6mol/(L·min) |
用铁片于稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是()
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
下列关于反应热的说法正确的是 ( )
| A.当∆H﹤0时,表示该反应为吸热反应 |
B.已知C(s)+ O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
从如图所示的某气体反应的能量变化分析,以下判断错误的是 ( )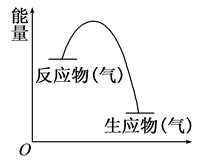
| A.这是一个放热反应 | B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 | D.反应物比生成物更稳定 |
下列反应既是氧化还原反应,又是吸热反应的是()
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量是( )
| A.[n/(A+16)]•(A-N+8)mol | B.[n/(A+16)]•(A-N+10)mol |
| C.(A-N+2)mol | D.[n/A]•(A-N+6)mol |