乙醇分子中不同的化学键如下图:关于乙醇在各种不同反应中断裂键的说明正确的是 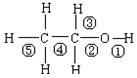
| A.和金属钠反应键②断裂 |
| B.和氧气反应键①断裂 |
| C.和浓硫酸共热170℃时键①或键②断裂 |
| D.和浓硫酸共热170℃时键②⑤断裂 |
天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:CH4+2O2→CO2+2H2O,C3H8+5O2→3CO2+4H2O现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是
| A.增大空气进入量或减小石油气进入量 |
| B.减小空气进入量,增大石油气进入量 |
| C.减小空气进入量,减小石油气进入量 |
| D.减小空气进入量或增大石油气进入量 |
2010年11月12日至27日广州成功举办了第16届亚运会.广州采取了一系列节能减排、改善环境质量的措施.下列说法错误的是
| A.发展核能发电,以减少火力发电带来的SO2和CO2的排放问题 |
| B.发展低碳经济,利用太阳能、风能实现城市照明 |
| C.推行“限塑令”,研发用二氧化碳合成聚碳酸酯类可降解塑料 |
| D.使用填埋法或焚烧法处理未经分类的生活垃圾 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收QkJ的能量,下列说法正确的是
| A.金刚石与石墨互为同位素 |
| B.石墨稳定 |
| C.金刚石稳定 |
| D.等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
下列设备工作时,将化学能转化为热能的是
A.硅太阳能电池 |
B.锂离子电池 |
C.太阳能集热器 |
D.燃气灶 |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可放出热量,则该反应的△H<0 |
| B.常温下浓硫酸与铝不反应,可用铝槽车运输 |
C.二氧化碳的电子式: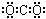 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小 |