用乙醇制取乙二醇(HOCH2—CH2OH),需要经过3个阶段,依次写出反应的化学方程式,并注明反应类型:
(1)反应方程式 ,反应类型 。
(2)反应方程式  ,反应类型 。
,反应类型 。
(3)反应方程式 ,反应类型 。
镁是一种重要的金属资源,在工业上用途广泛。回答下列问题:
(1)已知某温度下Mg(OH)2的Ksp = 6.4×l0-12,当溶液中c(Mg2+) ≤1.0×10-5mol/L可视为沉淀完全,则此温度下应保持溶液中c(OH-) ≥ ______mol·L-1。
(2)已知常温下CH3COOH的电离常数为:Ka = l.75×10-5mol/L;NH3·H2O的电离常数为,Kb =1.76×l0-5mol/L。A.NH4Cl溶液显酸性,原因是_________________________(用离子方程式表示),NH4Cl溶液中所有离子的浓度由大到小的顺序为_________________________;
B.CH3COONH4溶液显___________ (填“酸”、“碱”或“中”)性。
C.将饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,可看到白色沉淀溶解。产生这种现象的原因存在以下两种观点。
观点①:2NH4+ + Mg(OH)2= 2NH3·H2O+ Mg2+ ;
观点②的离子方程式为_________________________。
要验证①和②谁是Mg(OH)2溶解的主要原因,可选取______________(填序号)代替NH4Cl溶液作对照实验。
a. NH4NO3 b. (NH4)2SO4 c. CH3COONH4 d. NH4HSO4
在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) m C(g)(m为整数), A的转化率(αA)与温度(T)、压强的关系如图所示:
m C(g)(m为整数), A的转化率(αA)与温度(T)、压强的关系如图所示:
(1)此反应的正反应是_______________ (填“放热”、“吸热”)反应;
(2)m值为__________;
(3)若保持其它条件不变,升高温度,混合气体的平均相对分子质量_________ (填“增大” “减小”或“不变”);
(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,则乙硼烷的燃烧热的热化学方程式为______________。
(2)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。某化学过程如图所示,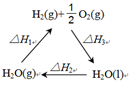
ΔH1、ΔH2、ΔH3三者之间的关系式为___________。
某温度下,纯水中c(H+) = 2×10-7 mol•L-1,则此温度____________25°C(填“>”、“<”或“=”)。若温度不变,滴入稀盐酸,使c(H+) = 8×10-4 mol•L-1,则此时溶液中由水电离产生的c(H+) =____________。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 |
H+ |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
未测定 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g)△H
2NO(g)△H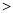 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。