将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:H2(g) + I2(g)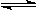 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)达平衡时,I2(g)的物质的量浓度为 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是 ,则乙条件可能是 。
(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条 件下,加入适当催化剂。
件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是 。
“温室效应”是全球关注的环境问题之一,科学家们一直致力于CO2的“组合转化”技术研究。例如将CO2和H2以1∶4或1∶3的比例混合,在适当条件下反应,生成H2O的同时可分别获得重要的气态能源物质A和对植物生长有调节作用的有机物B。请回答下列问题:
(1)写出生成A的化学方程式:(不必写反应条件)
(2)某小组做了如下三组对照实验来证实有机物B对植物生长的调节作用。
实验序号:①集气瓶中放青色、未熟的水果,在空气中盖上玻璃片。
实验序号:②集气瓶中放青色、未熟的水果,通入一定量的有机物B。
实验序号:③集气瓶中放青色、未熟的水果,瓶底放少量KMnO4固体。
该三组实验中,水果成熟的先后顺序为。(填实验序号)
(3)A分子的空间构型为。
(4)试推测丙烯(CH2=CH-CH3)的结构或性质,下列说法中不正确的是(填字母)
a.丙烯与氯化氢反应只有一种产物
b.丙烯可使酸性高锰酸钾溶液褪色
c.丙烯可使溴水褪色
d.丙烯能发生加成反应。
设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,回答如下问题:
(1)以丁烷(C4H10)为汽油代表,这个电池放电时发生反应的化学方程式是
;
(2)这个电池负极发生的反应是:C4H10 + 13O2— - 26e—=4CO2+5H2O,正极发生的电极反应方程式是:;固体电解质里O2-向极移动;向外电路释放的电子的电极是极;
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是:;
(4)汽油燃料电池最大的障碍是氧化反应不完全产生堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
原子序数大于4的主族元素A和B的离子Am+ 和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为______________,
② A和B的核电荷数之差为______________(用含m、n的代数式表示)
③ B和A的族序数之差为________________(用含m、n的代数式表示)
(共12分)I.按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式,食醋中的有机物结构式,糖尿病患者尿液中含的糖类结构简式。
II.铍和铝、锂和镁等在元素周期表中具有特殊的“对角线关系”,单质及化合物的性质十分相似。请按要求回答下列各问:
(1)写出Be与NaOH溶液反应的离子方程式(生成Na2BeO2):;(2)Be(OH)2与Mg(OH)2可用试剂鉴别,其离子方程式为:;
Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于晶体,比较Q、X、Y 第一电离能由大到小的顺序。
⑵ R的氢化物属于分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是;
⑷已知Ti3+可 形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测
形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测 溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为。
溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为。