烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系: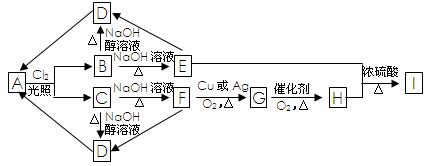
请回答下列问题:
(1)G的结构简式为 。
(2)E→D的反应类型是 反应。
(3)写出下列转化的化学方程式:
B→D
E+H→I
(4)H有多种同分异构体,写出满足下列两个条件的其中一种同分异构体的结构简式 。
①分子结构中有烃基。 ②与新制的Cu(OH)2共热生成红色沉淀。
亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快)④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由步反应决定。
在体积为2L的密闭容器中发生2SO2+O2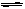 2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
2SO3反应,现控制下列三种不同的条件:①在400℃时,10molSO2与5molO2反应;②在400℃时,20molSO2与5molO2反应;③在300℃时,10molSO2与5molO2反应;
(1)问:开始时,正反应速率最快的是_________;正反应速率最慢的是_________。
(2)若10min内测得第①组的平均反应速率为:V(SO2)=0.4mol/(L·min),则10min时,生成的SO3浓度为。
某气体的分解反应在 的容器中进行,8分钟消耗反应物
的容器中进行,8分钟消耗反应物 。在另一条件下,该气体在
。在另一条件下,该气体在 容器中发生分解,10分钟内消耗反应物10g。在这两种情况下,平均反应速率之比为。
容器中发生分解,10分钟内消耗反应物10g。在这两种情况下,平均反应速率之比为。
(8分)如图,曲线表示在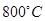 时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图像,试回答:
时,和某反应有关的物质A、B、C的物质的量浓度从开始反应至4分钟时的变化图像,试回答:
(1)该反的反应物是。
(2)4分钟时,C的浓度是B的倍。
(3)该反应的化学方程式是
(4)反应开始至4分钟,若用A的浓度来表示该反应的平均速率为
大理石与盐酸反应的反应速率如图所示,已知反应为放热反应。
(1)写出该反应的离子反应方程式:
(2)反应开始时反应速率加快的原因是。
(3)反应后期反应速率下降的原因是。