10℃时加热饱和NaHCO3溶液,测得该溶液的pH发生如表所示的变化。
| 温度/℃ |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液pH增大的原因是HCO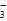 的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
的水解程度增大,故碱性增强,有关反应的离子方程式为__________________________。乙同学认为,溶液pH增大的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度,该分解反应的化学方程式为______________________________。
丙同学认为,甲、乙的判断都不充分,他进行如下探究来验证他们的判断是否正确。
(1)在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确,试剂X是________(填序号)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)的判断正确。
(3)丙同学查阅资料后发现,NaHCO3的分解温度为150℃,他断言________(填“甲”或“乙”)的判断是错误的,原因是________________________________________________。
[2012·西安交大附中一模]A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol·L-1A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
请回答下列问题:
(1)根据以上事实推断A—E的化学式:
A;B;C;D;E。
(2)请用离子方程式表示A溶液显碱性的原因。
(3)写出③、④的离子方程式:③;④。
某化学小组的同学到实验室学习。在实验桌上摆有下列仪器:
(1)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作:__________________________________。
(2)关于e的用途,乙同学说可组成防倒吸装置。你还能说出其他两种用途吗?
①_____________________________;②____________________________。
(3)丙同学想用下图装置用大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上面的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。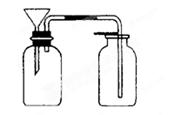
[2012·潍坊高三期末] (1)下面a~f是中学化学实验中常见的几种玻璃仪器:
a.烧杯b.容量瓶 c.试管 d.量筒 e.滴定管 f.圆底烧瓶
①其中标出仪器使用温度的是________(填编号,下同);
②使用前要检查仪器是否漏液的是________;
③可作反应容器并可直接加热的是________。
(2)化学是一门以实验为基础的科学,化学实验是学习的重要内容。根据你掌握的知识,判断下列描述正确的是(填序号)。
| A.将一块pH试纸浸入稀盐酸中,测定溶液pH |
| B.用25mL酸式滴定管量取18.80mLKMnO4溶液 |
| C.用苯萃取碘水中的I2时,有机层从分液漏斗的上口倒出 |
| D.各放一张质量相同的滤纸于天平的两盘上,将NaOH固体放在左盘纸上称量 |
E.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,则该钾盐为K2CO3
F.向某溶液中加入Ba(NO3)2溶液有白色沉淀产生,加盐酸沉淀不消失,则原溶液中一定含有SO42-
[2012·江西鹰潭一模]A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为,反应④的化学方程式为:。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是,用电子式表示B分子的形成过程。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为,分子E的结构式为。
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。则:
①用太阳能分解10mol水消耗的能量是_____________kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________。
(3)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0 kJ·mol-1
CO(g)+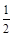 O2(g) =CO2(g),△H=-283.0 kJ·mol-1
O2(g) =CO2(g),△H=-283.0 kJ·mol-1
C(石墨)+O2(g) =CO2(g),△H=-393.5 kJ·mol-1
则4Fe(s)+3O2(g) =2Fe2O3(s),△H=。