[2012·江西鹰潭一模]A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为 ,反应④的化学方程式为: 。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,用电子式表示B分子的形成过程 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 ,分子E的结构式为 。
以合成氨工厂工艺流程如下图,试回答相关问题: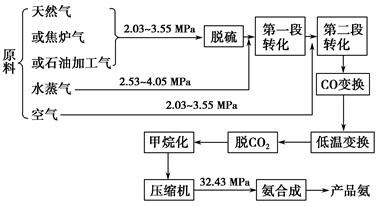
(1)不同的原料生产氢气其经济指标如下表:
| 天然气 |
石脑油 |
重油 |
煤焦 |
|
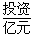 |
5.6 |
6.5 |
8.0 |
- |
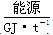 |
28~30 |
35.5 |
41.8 |
54.4 |
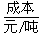 |
257 |
390~447 |
220~280 |
500 |
从上表数据及自然资源来看最具发展前景的是________。
A.天然气B.石脑油C.重油 D.煤焦
(2)脱硫工艺一般是通过金属氧化物来实现的,通过三步反应最后再生成金属氧化物,并得到单质硫,请补充第三步反应。
①MezOy+zH2S+(y-z)H2=MezSz+yH2O
②MezSz+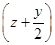 O2=MezOy+zSO2
O2=MezOy+zSO2
③__________________________________________________
(3)气体的精制 经净化过的气体仍有少量的CO等有害气体。常用的方法有铜洗法和甲烷化法。CO(g)+Cu(NH3)2Ac+NH3(l)[Cu(NH3)3CO]Ac;正反应放热,反应在铜洗塔中进行,吸收后的铜液送到再生器中,在再生器处解吸CO,适宜条件是________,解吸后铜液循环使用。甲烷化法则是把CO、CO2转化为对氨合成无害的CH4,主要反应是CO(g)+3H2(g) CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。
CH4(g)+H2O(g);正反应放热,甲烷化的条件是__________________。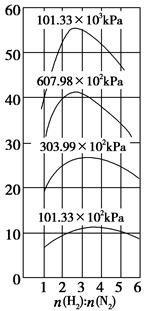
(4)500 ℃时,y随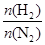 及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的
及压强的变化关系。纵坐标可能是____________,结合目前生产的条件,应控制的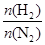 是________。
是________。
锌锰废电池经处理后,生产并回收硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
试回答下列问题:
(1)锰在元素周期表中位于第________周期,第________族。
(2)步骤1和步骤2是将MnO2转化为MnO并溶于硫酸,其中步骤2中的氢气,是另一个流程产生的副产品,请写出产生氢气的反应方程式__________________________。
(3)步骤3和步骤4都是除杂质。
①X是一种“绿色”氧化剂,则X是________(填化学式)。
②步骤3是除去杂质Fe2+。请用文字和必要的方程式简述除去Fe2+的方法(已知三种离子沉淀的pH范围为Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6)_________________________________________________________。
③步骤4中主要反应方程式为:MeSO4+BaS=MeS↓+BaSO4↓(Me主要为Pb、Cd、Hg等),则其除去杂质的原理是_________________________________________________。
(4)已知进行步骤5的操作时,溶液3(主要成分为MnSO4)会产生大量无色无味的气泡,则步骤5反应的化学方程式为_______________________________________。
下表列出了3种燃煤烟气脱硫方法的原理。
| 方法Ⅰ |
用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ |
用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有________(填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D.通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是____________(用离子方程式表示)。
(2)方法Ⅱ中主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=8.0 kJ·mol-1
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=90.4 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为________。
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如下图所示。阳极区放出气体的成分为________(填化学式)。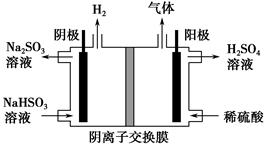
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:______________________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:____________________________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g)ΔH=-90.8 kJ·mol-1
CH3OH(g)ΔH=-90.8 kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
CO2(g)+H2(g)ΔH=-41.3 kJ·mol-1
总反应3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g)的ΔH=________;
CH3OCH3(g)+CO2(g)的ΔH=________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
①比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=________;该时间内反应速率v(CH3OH)=________。
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: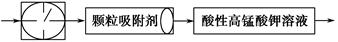
①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。