决定化学反应速率的主要因素是
A反应物的浓度 B、反应温度
C、催化剂 D、反应物的性质
已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是拉伸注射器 |
| B.d点:v(正)< v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
已知阴离子交换膜只允许阴离子通过。某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入下图所示的装置中进行电解。下列说法中不正确的是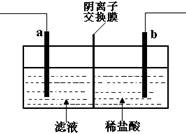
| A.电解时,电极a应与外电源的正极相连 |
| B.电解时,电极b周围产生无色无味的气体 |
| C.电解时,电极a发生的反应是:2Cl――2e-= Cl2↑ |
| D.电解时,可以用氯化钠溶液替代稀盐酸 |
下列说法正确的是
| A.等质量的乙酸、葡萄糖与淀粉完全燃烧时消耗氧气的质量相等 |
| B.醇、醛和羧酸都溶于水,烃与酯的密度都小于1g/cm3 |
| C.豆浆中富含大豆蛋白,煮沸后蛋白质水解成了氨基酸 |
| D.某烯烃(最简式为CH2)与H2加成产物为2,3—二甲基丁烷,则该烯烃可能有2种结构 |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,Y原子的核外电子数是内层电子的4倍,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.元素Q的最高价氧化物对应的水化物酸性比W的强 |
| B.化合物W2Q2中,各原子最外层均达8电子结构 |
| C.工业上通过电解Z与Q形成的化合物制备Z单质 |
| D.Y单质与X的气态氢化物可发生置换反应 |
利用下列实验器材(规格和数量不限,夹持仪器不限),不能完成相应实验的选项是
| 实验器材(省略夹持装置) |
相应实验 |
|
| A |
烧杯、锥形瓶、试管、温度计 |
探究温度对H2SO4和Na2S2O3反应速率的影响 |
| B |
烧杯、玻璃棒、胶头滴管、漏斗、滤纸 |
用盐酸除去硫酸钡中的少量碳酸钡 |
| C |
烧杯、玻璃棒、胶头滴管、容量瓶、电子天平 |
用固体氯化钠配制100 mL0.5 mol·L-1的溶液 |
| D |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用溴水和CCl4除去NaBr溶液中的少量NaI |