在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的 反应。
反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: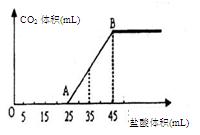
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式 ;
下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是▲;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式:▲。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:▲。
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有▲个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为▲(必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了▲杂化。
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。 提出猜想
提出猜想 Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种; Ⅱ.所得气体中可能含有▲中的一种或两种。
Ⅱ.所得气体中可能含有▲中的一种或两种。 实验探究
实验探究
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
▲ |
▲ |
| 步骤②:▲ |
▲ |
含有Fe3+ |
|
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
▲ |
含有两种气体 |

下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,
、
为活塞)。







(1)若气体入口通入
和
的混合气体,
内放置
,选择装置获得纯净干燥的
,并验证其还原性及氧化产物,所选装置的连接顺序为(填代号)。能验证
氧化产物的现象是。
(2)停止
和
混合气体的通入,E内放置
,按
装置顺序制取纯净干燥的
,并用
氧化乙醇。此时,活塞
应,活塞
应。需要加热的仪器装置有(填代号),
中反应的化学方程式为。
(3)若气体入口改通空气,分液漏斗内改改加浓氨水,圆地烧瓶内改加
固体,
内装有铂铹合金网,按
装置程序制取干燥氧气,并验证氨的某些性质。
①装置
中能产生氨气的原因有。
②实验中观察到
内有红棕色气体现出,证明氨气具有性。
四种元素
、
、
、
位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;
原子的
层
轨道中有2个电子;
与
原子的价层电子数相同;
原子的
层电子数与最外层电子数之比为4:1,其
轨道中的电子数与最外层电子数之比为5:1。
(1)
、
可分别与
形成只含一个中心原子的共价化合物
、
,它们的分子式分别是、; 杂化轨道分别是、;
分子的立体结构是。
(2)
的最高价氧化物和
的最高价氧化物的晶体类型分别是晶体、晶体:
(3)
的氧化物与
的氧化物中,分子极性较小的是(填分子式);
(4)
与
比较,电负性较大的, 其+2价离子的核外电子排布式是
让直径比孔穴小的分子通过而将大的分子留在外面,故又称“分子筛”。“分子筛”在表面化学中有重要作用,是重要的催化剂和催化剂载体。以高岭土(主要成分:Al2Si2O7·2H2O)、石灰石、海水为原料生产“分子筛”的工艺流程如下:
回答下列问题
(1)操作a的作用是,副产品A是;
(2)气体通入滤液中发生反应的离子方程式为、;
(3)NaOH和不溶物在适当温度下发生的化学反应方程式为、
;
(4)高岭土主要成分的化学式可表示为Al2O3·2SiO2·2H2O,则分子筛的化学式也可表示为。