下图所示为常见气体制备、分离、干爆和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,、为活塞)。







(1)若气体入口通入和的混合气体,内放置,选择装置获得纯净干燥的,并验证其还原性及氧化产物,所选装置的连接顺序为(填代号)。能验证氧化产物的现象是。
(2)停止和混合气体的通入,E内放置,按装置顺序制取纯净干燥的,并用氧化乙醇。此时,活塞应,活塞应。需要加热的仪器装置有(填代号),中反应的化学方程式为。
(3)若气体入口改通空气,分液漏斗内改改加浓氨水,圆地烧瓶内改加 固体,内装有铂铹合金网,按装置程序制取干燥氧气,并验证氨的某些性质。
①装置中能产生氨气的原因有。
②实验中观察到内有红棕色气体现出,证明氨气具有性。
化学反应N2+3H2= 2NH3的能量变化如图所示,该反应的热化学方程式是:N2(g)+3H2(g) = 2NH3(l);⊿H =.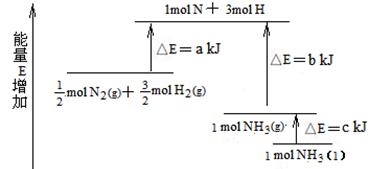
短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n可能的关系是(写出两个即得满分).
在短周期元素中:①金属性最强的元素是______,与水反应最剧烈的非金属是_____;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.
在11~18号的元素中,③原子半径最小的元素是________;④元素最高价氧化物中既能与盐酸反应又能与烧碱反应,该氧化物是________.
1L某烃的蒸气完全燃烧生成的CO2比水蒸汽少1L(同温同压下测定);0.1mol该烃完全燃烧后的产物被碱石灰充分吸收,碱石灰增重39g。求:
(1)该烃的分子式。
(2)若该烃的一氯代物有三种,写出该烃所有可能的结构简式和名称。
随着经济的不断发展,人们对环境问题也越来越关注。
(1)室内空气污染问题得到越来越多的关注,下列物质中也属于室内挥发性有机污染物的是
___________________。(填字母)
a.苯 b.甲烷 c.醋酸 d.乙烯
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料 d.室内放一些活性碳
(3) “温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O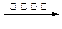 C6H12O6+6O2 b.CO2 + 3H2
C6H12O6+6O2 b.CO2 + 3H2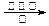 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4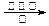 CH3COOHd.2CO2 + 6H2
CH3COOHd.2CO2 + 6H2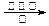 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是,原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)最高的是。
(4) “汽车尾气污染”已倍受世人关注。以辛烷(C8H8)代表汽油的成分,要使辛烷正好完全燃烧,则辛烷气与空气(空气中O2占1/5体积)的体积比(相同条件下)为(保留三位小数)。