已知M2+离子3d轨道上有5个电子,则
(1)M原子的外围电子排布图(轨道表示式)为: 。
(2)M原子的最外层电子数为 个;最高能级中电子数为 个。
(3)M元素在周期表中的位置是: 。
下表为元素周期表的一部分。请回答下列问题:
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为,该晶体的密度为(用字母表示)
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表: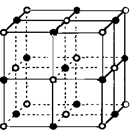
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:(用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有个。
今有下列气体:H2、Cl2、HCl、NH3、NO、H2S、SO2,用如图所示的装置进行实验,填空下列空白: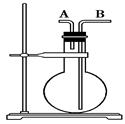
(1)烧瓶干燥时,从A口进气可收集的气体是________,从B口进气可收集的气体是______________。
(2)烧瓶中充满水时,可用来测量___________等气体的体积。
(3)当烧瓶中装入洗液,用于洗气时,气体应从________口进入烧瓶。
根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料:,电极反应式:
正极材料:,电极反应式:
电解质溶液:。
(1)下列五种物质中①Ne ②H2O ③NH3④KOH ⑤Na2O,只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是,仅发生离子键破坏的是,仅发生共价键破坏的是。(填写序号)
用如图所示装置可以收集以下几种气体(烧瓶位置不动)(填字母,下同);
①H2②SO2③CH4④ HCl ⑤ NH3⑥ NO⑦H2S
(1)若烧瓶是干燥的,则由A口进气,可收集到的气体有,由B口进气,可收集的气体有。
(2)若在烧瓶中充满水,可收集的气体有,气体由口进入。
(3)若此装置用于净化气体,在烧瓶内装有洗涤液,则混合气体应由口进入。