已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是______________
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________
A HCN B HClO C C6H5OH D CH3COOH E H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:
3SiCl4 +2N2 +6H2 Si3N4 +12HCl
Si3N4 +12HCl
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于 晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是(填写元素符号);属于非极性分子的化合物的电子式是。
(2)比较Si和Cl两种元素非金属性强弱的方法是。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为(简述理由),写出Si与强碱溶液反应的离子反应方程式:。
G是一种工业增塑剂,其合成的流程如下:
已知:(1)A侧链上有两种不同环境下的氢原子;(2)B是芳香烃
(1)A中含氧官能团的名称,F的分子式,
C→D的反应条件,B的结构简式。
(2)A1是与A含有相同官能团的同分异构体,同条件下也能制得B,写出A1生成B的化学方程式。
(3)写出D→E的化学方程式。
(4)F物质的消去产物H是一种药物中间体,关于H的下列叙述正确的是。
a.能发生取代、消去、氧化、加聚反应
b.将H加入溴水中,振荡后得到无色溶液
c.等物质的量H与F反应后,生成物可能的分子式C18H16O4
d.1mol H在一定条件下与H2反应,最多消耗H2 4mol
(5)E有多种同分异构体,符合下列条件的芳香族同分异构体共有种。
①既能与稀硫酸又能与NaOH溶液反应②能发生银镜反应
③分子中只有一个甲基
特戊酸是一种重要的化学试剂和化工原料, 工业上可用异丁烯与一氧化碳和水蒸气或叔丁醇与甲酸反应制得。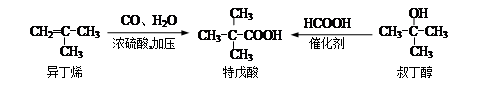
根据题意回答下列问题:
(1)用系统命名法命名特戊酸___________,异丁烯最简单的同系物的分子式是_________;甲酸分子中含有的能体现主要化学性质的官能团的名称是_______________。
(2)聚合度不大的聚异丁烯能给化妆品以极好而高贵的手感,写出异丁烯发生聚合反应的化学方程式:_____________________________________。
(3)异丁烯二聚物(二异丁烯)再与氢气加成可制得优质汽油,二聚是一分子甲基上的碳-氢键断裂后与另一异丁烯分子中的双键发生加成反应,写出二聚加成产物可能的结构简式:_________________________________________。
(4)叔丁醇同类别的同分异构体(含叔丁醇)有________种(填写数字),写出叔丁醇与甲酸发生酯化反应的化学方程式: _____________________________________________________。
(5)特戊酸稳定的同分异构体中的一个分子中不可能同时含有____(填写编号)。
a.2个-CHO b.1个–OH和1个-CHO
c.2个–OH d.1个-COO-和1个环
碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| 活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
| 初始 |
2.030 |
0.100 |
0 |
0 |
| 平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为mol/(L·min);当活性炭消耗0.015mol时,反应的时间(填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理。
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业上通过煅烧铬铁矿制取,其反应如下:
反应Ⅰ 4Fe(CrO2)2+8Na2CO3+7O2 → 2Fe2O3+8Na2CrO4+8CO2
反应Ⅱ 2CrO42- + 2H+ → Cr2O72- + H2O
反应Ⅲ 3CrO42- + 4H+ →Cr3O102- + 2H2O(副反应)
(1)上述反应中不属于氧化还原反应有个。已知Fe(CrO2)2中铬元素是+3价,关于反应Ⅰ的下列说法中正确的是。
a.被氧化的元素只有+3的Cr,被还原的元素只有0价的O
b.氧化剂与还原剂的物质的量之比为4:7
c.每生成1molCO2,转移3.5mol电子
d.每摩尔+3的Cr能还原0.75mol氧气
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O72-,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式并标出电子转移的方向和数目:。
(3)某厂废水中含1.00×10−3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2)。欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入g FeSO4·7H2O。