下图是各个原子的性质和原子序数(1~20)的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、中子数、最高正价、原子半径相对大小、得电子相对能力。图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值。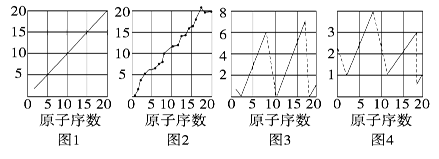
(1)图1~图4的纵轴分别代表________、________、______。
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:a+b=c,(e+c)/2=c,(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A~G六种具体元素符号填在表中相应的位置。
②写出铜与上述某一元素最高价氧化物对应水化物反应的化学方程式: _________(任写一个即可)。
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,其相应的化学方程式为__________;若X、Y、Z、W均为化合物,其相应的化学方程式为______________________________(任写一个,合理即可)。
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
(13分)Ⅰ:已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成Cl-、ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。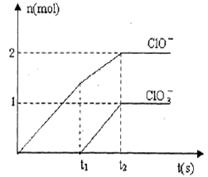
(1)t1时,开始有ClO3-生成的原因是_________________。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为 ___________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是_________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为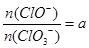 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。
Ⅱ下图中,是电解NO制备 NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3。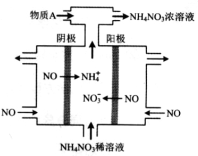
(1)阳极发生的电极反应式为。
(2)需补充物质A,A是_____________,说明理由:________________。
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–:,
则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+==2FeCl2+H2SO4+2HCl,反应中的氧化产物是(写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在;
假设3:溶液中存在Fe2+ 而不存在H2SO3(二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 |
若出现血红色,则假设1成立; (2)若未出现血红色,则假设2或假设3成立。 |
步骤2: |
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下: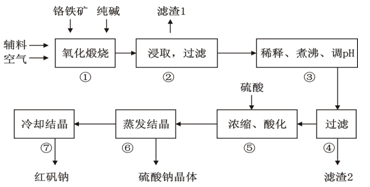
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3 Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是。
(2)“③”中调节pH至4.7,目的是。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42-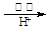 Cr3+
Cr3+ Cr(OH)3。绿矾还原CrO42-的离子方程式为:
Cr(OH)3。绿矾还原CrO42-的离子方程式为:
。
用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是Kg(保留两位小数)。
步骤⑦的操作是。为进一步得到较为纯净的红矾钠的操作是
已知
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: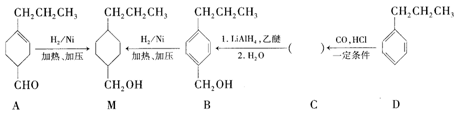
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4c.乙酸乙酯d.KMnO4/H+溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物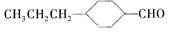 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。