某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,已知该有机物含氧27.3%。C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。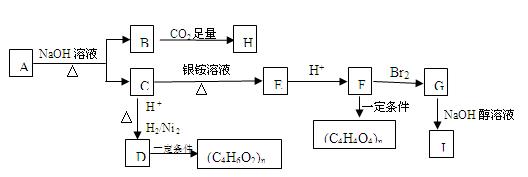
(1)A的分子式为 。A→B+C的反应方程式为 。
(2)写出由B生成H的反应方程式为 。
(3)与D具有相同官能团的同分异构体有几种: 。
(4)G的结构简式为 ,由G到J的反应类型为 。
(8分)已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,根据图中的能量图,回答下列问题:
(1)分别写出①②的数值:
① ▲;② ▲。
(2)生成H2O(g)中的1mol H-O键放出 ▲kJ的能量。
(3)已知:H2O(l)= H2O(g)DH=" +44" kJ·mol-1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式: ▲。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是____,写出在沉淀池的离子方程式____。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的____。
(3)操作A是____,操作B是____。
(4)加入的足量试剂a是____(填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为。从考虑成本和废物循环利用的角度,副产物氯气可以用于____。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你____(填“同意”或“不同意”)该同学的想法,理由是____。
有A、B、C、D、E五种短周期元素,已知相邻的A、 B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2。E的阳离子与A的阴离子核外电子层结构完全相同。回答下列问题:
(1)五种元素的名称:A______,B______, C______,D______,E______。
(2)B、C、D元素的原子半径由大到小的顺序为__________________________,
它们的最高价氧化物对应水化物的酸性强弱顺序为_________________________。
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式____。
(4)A与E形成的化合物的化学式是____,它的性质决定了它在物质的分类中应属于____。
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是____,有关反应的离子方程式为____。
已知A是乙烯,B、C、D、E均为常见的有机物,在一定条件下,它们有如下图所示的转化关系。
请回答:
(1)C的结构简式是______。
(2)能与金属钠反应放出氢气的物质有______(填字母)。
(3)在图示转化关系中,属于氧化反应的有______(填序号)。
(4)A、B、C三种物质的摩尔质量由大到小的顺序是______。
(5)反应⑤的化学方程式是______(有机物用结构简式表示)。
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示。回答下列问题:
(1)反应开始到10s,用Z表示的反应速率为;
(2)反应开始到10s,X的物质的量浓度减少了;
(3)反应开始到10s时,Y的转化率为;
(4)反应的化学方程式为。