目前世界上比较先进的电解制碱技术是离子交换法,如图为 阳离子交换膜法电解饱和食盐水的原理示意图。
阳离子交换膜法电解饱和食盐水的原理示意图。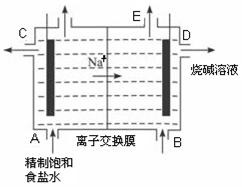
(1)下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D .粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),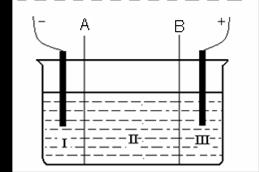
在这 种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。
A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
(共5分,每空1分)测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b。
(2)若所得混合液的pH=2,则a︰b。
(共6分,每空2分).从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________________________;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是________________________________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_________________________________。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为、;
(3)5min后Z的生成速率比5min末Z的生成速率(大、小、相等)。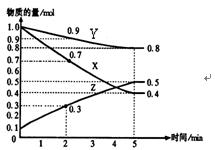
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则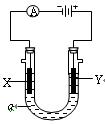
(1)电解过程中反应的总化学方程式为;X极附近观察到的现象是。
(2)Y电极上的电极反应式为,检验该电极反应产物的方法是。
A、B、C、D 4种元素,其中A、B、C为短周期元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)B元素的名称;B在周期表中的位置第周期,第族;
(2)A、B形成的化合物的电子式;
(3)C的元素符号,C的最高价氧化物的化学式;
(4)D的最高价氧化物对应的水化物的化学式。