某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。
(夹持装置省略)
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为 。
[实验二] 样 品溶于水后用盐酸滴定
品溶于水后用盐酸滴定
(3)取一定量样品溶于水并配制成250 mL溶液,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 标准盐酸体积(mL) |
23.00 |
24.98 |
25.00 |
25.02 |
由表中数据可知,标准盐酸体积的平均值为 mL。若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是 (填“偏高”、“偏低”或“无影响”)。
[实验分析] 实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
。
某同学设计如下实验方案,并记录了有关实验现象,如下表。请你帮助该同学整理完成实验报告。
(1)实验目的:____________________________________________。
(2)实验用品:仪器________________________________________。
试剂________________________________________。
| 实验方案 |
实验现象 |
||||
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞溶液 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞的冷水反应 4.镁带与2 mol·L-1盐酸反应 5.铝条与2 mol·L-1盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
(3)实验内容:
| 实验方案* |
实验现象* |
有关化学方程式 |
(4)实验结论:_________________________________________________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
实验室用电石和水反应制备的乙炔气体中含有少量的H2S气体,为了净化和检验乙炔气体,并通过测定乙炔的体积计算电石的纯度,按下列要求填空(注意X溶液为含溴3.2%的CCl4溶液150 g):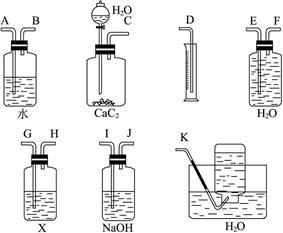
(1)试从图中选用几种必要的装置,把它们连成一套装置,这些被选用的接口编号连接顺序是____________________________________________________________。
(2)实验室能否用启普发生器制乙炔,其原因是______________________________________。
(3)为了得到比较平稳的乙炔气流,常可用_______________代替水。
(4)假设溴的四氯化碳溶液与乙炔完全反应,生成C2H2Br4,用W g的电石与水反应后,测得排入量筒内液体体积为V mL(标准状况下),则此电石纯度计算式为_______________。
(12分)实验室制取乙烯的实验中:
(1)浓H2SO4的作用是_____________________________________________。
(2)浓H2SO4与酒精混合的操作是______________________________。
(3)迅速升温至170 ℃的原因是_____________________________________________。
(4)有效控制反应温度的方法是_____________________________________________。
(5)反应后一阶段的混合液体常变黑,并有刺激性气体生成,除去气体的方法是___________
_______________。
(6)在实验之前,首先应_______________,实验结束时,应先_______________。
如下图,当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化。完成下列问题: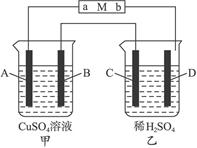
(1)甲、乙分别是什么装置____________、____________。
(2)写出A、B、C、D的电极名称以及电极材料和电极反应式________________________。
电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X电极上的电极反应式为________。在X极附近观察到的现象是________。
②Y电极上的电极反应式为________,检验该电极反应产物的方法是________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是________,电极反应式为________________。
②Y电极的材料是________,电极反应式为________________(说明:杂质发生的电极反应不必写出)。