在25℃时,用石墨电极电解2.0 L,2.5 mol/L CuSO4溶液,如有0.2 mol电子发生转移,试回答下列问题:
⑴电解后得到的Cu的质量是 ,得到O2的体积(标准状况)是 ,溶液的pH是 。
⑵如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差 ,电解液的pH (填“变小”、“变大”或“不变”)
有E、Q、T、x、z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态E原子占有三个能级且每个能级中电子数目相等,基态Q原子的2p轨道处于半充满状态,X为周期表中前四周期电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)氢元素和E、Q两种元素形成分子式为HEQ的化合物,HEQ分子属于分子(填“极性”或“非极性”),分子中有个σ键。
(2)与分子式为ET互为等电子体的离子是(写出一种即可)。基态Z原子的核外电子排布式____。
(3)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有(写两种)。
(4)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为。甲与E的最高价氧化物反应的方程式为。
(5)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石。
①乙的晶体类型为;②乙的晶体中Q元素原子的杂化方式为。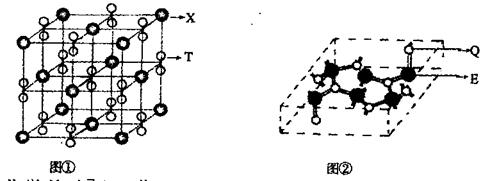
为减少CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。最近科掌家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下: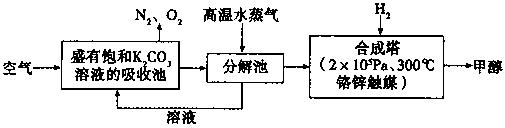
(1)请写出上述流程中分解池中发生反应的化学方程式。
(2)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水、甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
(3)若在体积为2L的密闭容器中,充入2molCO2和6rnolH2,一定条件下发生上述反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=;氢气的转化率;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有。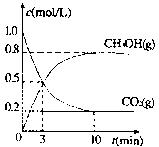
(4)某同学用测定法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。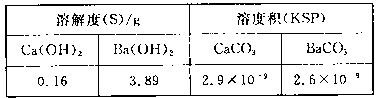
吸收CO2最合适的试剂是____(填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定____。
(5)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括。
(6)常温下,0.1 mol/L KHCO。溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:____。
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G是淡黄色固体,F为棕黄色溶液,①是实验室制取丙的反应之一,各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):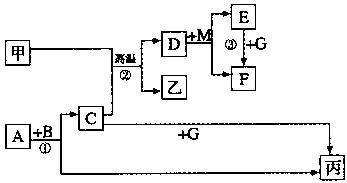
(1)写出A的电子式、B的化学式、甲在周期表中位置是。
(2)写出反应②的化学方程式:。
(3)写出反应③中E与G在中性条件下按物质的量之比2:1反应的离子方程式。
(4)整个转换过程中属于氧化还原反应的有个
(5)物质X常用于对空气进行杀菌、净化和水果保鲜等。X和丙的组成元素相间,X分子中各原子最外层电子数之和为18。X和酸性碘化钾溶液反应生成丙和碘单质,反应的离子方程式是____。
已知: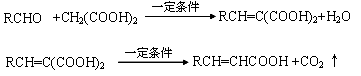
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)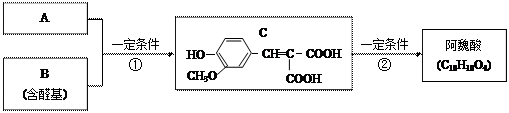
A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体。
(1)A的结构简式是________________。
(2)在中学学过知识里 B不可能发生的反应是________ (填序号)
a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3) 等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________
等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________
(4)写出C与足量的Na2CO3的化学方程式为:__________________________________
(5)写出符合下列条件的阿魏酸所有的同分异构体的结构简式:__
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体;
④该同分异构体进行核磁共振氢谱分析发现只有4种峰。
(6)写出利 用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
_______________________________________________________。
M、Q、X、Y、Z是前四周期的5种元素,原子序数依次增大,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| M |
M的一种单质是自然界最硬的物质 |
| Q |
基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请回答以下问题:
(1)a.学生甲根据M原子易形成4对共用电子的特点,推出M原子应该具有4个未成对电子。画出基态M原子的价层电子排布图为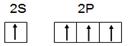 ,请判断对错,并加以解释
,请判断对错,并加以解释
b.M的另一种单质被称为混合型晶体,具有平面层状结构。M原子的杂化方式为________,其晶体中含有的作用力为________________________________________
(2)写出与Q单质分子互为等电子体的常见微粒的化学式(分子、阴离子各1个)、;并写出该阴离子的 电子式___________
电子式___________
(3)a.学生乙通过查表,确定Q与Y的电负性接近。但是Q的氢化物分子间能形成氢键,X的氢化物分子间却不易形成氢键,试从结构的角度加以解释:
b.氢键的形成,对分子的沸点影响较大,请判断以下两种互为同分异构体的分子沸点高低:
邻羟基苯甲酸 ______ 对羟基苯甲酸,原因是_________________________________
c.含氧酸的酸性与非羟基氧的个数有关,则Y的四种常见的不同价态含氧酸的酸性由强到弱排序为: