盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=―24.8kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=―47.2kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________________________________________________
.现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层电子数比K层电子数多4个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
。
(3)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是(填化学式)。
SO2和CO2均可使澄清石灰水变浑浊,现将混合气体SO2和CO2依次通过①品红;②酸性高锰酸钾;③品红;④澄清石灰水;请写出对应序号的现象和作用;
①品红;现象;作用;
②酸性高锰酸钾;现象;作用;
③品红;现象;作用;
④澄清石灰水;现象;作用;
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),理由是___________________(提示对比二者晶体类型及内部微粒作用力)
(3)如右图立方体中心的“·”表示金刚石晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的碳原子;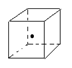
(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g)高温Si(s)+4HCl(g)
计算该反应的反应热△H为______________________(要包含数据和焓变单位)
、A、B、C、D四种元素,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1。
(1)上述四种元素的化学式:A、B、C 、D 。
(2)写出C2+离子的电子排布式
(3)A、B、C三种元素所形成的化合物中所包含的所有化学键的类型
28.已知乙烯能发生以下转化:
(1)乙烯的结构式为:
(2)写出化合物官能团的化学式及名称:
B中含官能团名称;D中含官能团名称;
(3)写出反应的化学方程式
①:
②:
③: