电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
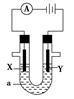
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则:
①电解池中Y电极上的电极反应式为 ;在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:①X电极的材料是 ,电极反应式为 。
②Y极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)。
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_______。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: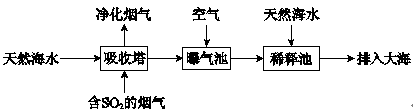
①向曝气池中通入空气的目的是_______。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_______。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______。
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)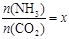 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
③上图中的B点处,NH3的平衡转化率为_______。
X、Y是短周期同主族元素,Z是过渡元素,化合物Z2X、Z2Y可发生如下转化。
(1)X的元素符号为_______,Z2Y的化学式为_______。
(2)蓝色溶液中含有的阴离子是_______。
(3)过程②中发生反应的离子方程式为_______。
25℃时,下图烧杯中各盛有25 mL的溶液。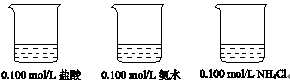
甲乙丙
(1)甲溶液pH=_______。
(2)若将甲溶液全部倒入乙中,所得的混合溶液的pH(填“>”、“<”或“=”)_______
丙溶液的pH。
(3)若将乙溶液全部倒入丙中,所得的混合溶液pH>7,所得溶液中离子浓度大小顺序是 _______。
运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=;用离子方程式表示FeCl3溶液用于净水的原因。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。
在NaHSO4溶液中c(H+)c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为。(已知Ksp(BaSO4)=1.1×10-10)
(4)写出下列反应的化学方程式:
苯的硝化反应 。 乙醇的催化氧化反应。