某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是_________(填字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→___________________________→用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)按图乙所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是()
A.用铝箔包住钠 B.用锡箔包住钠 C.直接将钠投入的水中
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶共排出水的体积为112 mL,塞紧带有钠的塞子,反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均属于标准状况,则所用金属钠的质量是克。
某校的研究性学习小组进行测定混合物各组分质量比的研究,甲、乙、丙三位同学各设计了一种实验方案如下表所示:(混合物的质量事先已称量好)
| 实验 序号 |
混合物 |
第一步:加入适量水,充分溶解 |
第二步:加入或通入的试剂 |
第三步:过滤后洗涤干燥所得固体 |
第四步:蒸发滤液得到晶体 |
第五步:称量,记录数据计算质量比 |
| 甲 |
BaCl2 NaCl |
澄清溶液 |
过量CO2 |
无固体 |
晶体 |
称量所得 晶体 |
| 乙 |
CaCl2 NaCl |
澄清溶液 |
过量饱和 Na2CO3溶液 |
CaCO3 |
NaCl |
称量蒸发 所得晶体 |
| 丙 |
Na2SO4 MgSO4 |
澄清溶液 |
过量NaOH 溶液 |
试回答下列问题:
(1)你认为甲同学设计的实验步骤中,根据称量所得到的数据,(填“能”或“不能”)准确计算出混合物中各组分的质量比。
(2)经讨论大家认为,乙同学所设计的实验步骤的第四步填写一定有错误。其原因是什么?。
(3)丙同学对实验进行了较合理的设计,将其后三步相应内容仿照前面的形式填入对应的空格内。
下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。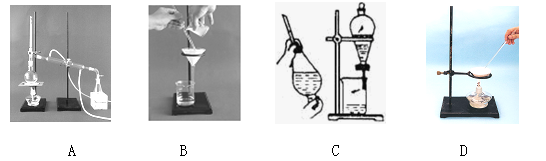
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去粗盐中的泥沙;
(6)与海水晒盐原理相符的是。
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]2KMnO4 + 5H2C2O4 + 3H2SO4 ="==" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
[实验内容及记录]
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||
| 1 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
| 3 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4) = 。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。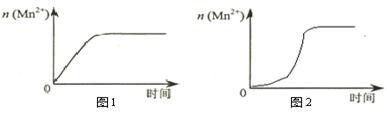
①该小组同学提出的假设是。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 |
室温下,试管中所加试剂及其用量 / mL |
再向试管中加入少量固体 |
室温下溶液颜色褪至无色所需时间 / min |
|||
| 0.6 mol/L H2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 4 |
3.0 |
2.0 |
3.0 |
2.0 |
t |
③若该小组同学提出的假设成立,应观察到的现象是。
化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。图中所列装置是用燃烧法确定有机物分子式常用的装置。(每一组仪器只能使用一次)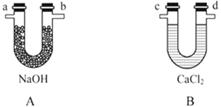
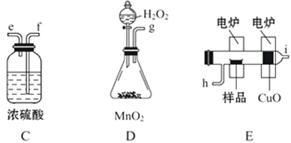
回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是_____ 。
(2)C装置中浓硫酸的作用是_____ 。
(3)D装置中MnO2的作用是_____ 。
(4)若准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22 g,B管质量增加10.8 g,则该有机物的最简式为_____ 。
(5)要确定该有机物的分子式,则_____ (填“是”或“不”)需要测定其他数据,若能确定其分子式,若其一氯代物只有一种,则其结构简式为_____ 。