铁与稀硫酸反应制取氢气,下列措施一定能使生成氢气的速率加快的是
| A.增大硫酸的浓度 | B.减小硫酸的浓度 |
| C.增加铁的量 | D.加热 |
根据价层电子对互斥理论及原子的杂化理论判断NF3分子的空间构型和中心原子的杂
化方式为( )
| A.直线形 sp杂化 | B.三角形 sp2杂化 |
| C.三角锥形 sp2杂化 | D.三角锥形 SP3杂化 |
下列化学式对应的结构式从成键情况看不合理的是( )
A.CH3N,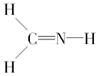 |
B.CH2SeO,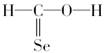 |
C.CH4S, |
D.CH4Si,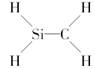 |
在乙稀分子中有5个σ键,一个π键,它们分别是( )
| A.sp2杂化轨道形成σ键;未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键;未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键 |
| D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键 |
下列有关σ键和π键的说法错误的是( )
| A.含有π键的分子在反应时,π键是化学反应的积极参与者 |
| B.当原子形成分子时,首先形成σ键,可能形成π键 |
| C.有些原子在与其他原子形成分子时只能形成σ键,不能形成π键 |
| D.在分子中,化学键可能只有π键而没有σ键 |
SiCl4的分子结构与CCl4类似,对其作出如下判断:①SiCl4晶体是分子组成的晶体②常温、常压下SiCl4是液体③SiCl4的分子是由极性键组成的非极性分子④SiCl4熔点高于CCl4。其中正确的是( )
| A.只有①②③ | B.只有①② |
| C.只有②③ | D.①②③④ |