“旺旺雪饼”袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。为此我对干燥剂的有关问题进行相关探究:
(1)问题1:为什么生石灰(CaO)可作干燥剂?(用化学方程式表示) 。
(2)我又对它作了一系列探究,获得较多收益,其有关实验方案如下:
| 问题与猜想 |
实验步骤 |
实验现象 |
实验结论 |
| 问题2:小纸袋中的物质 能否继续作干燥剂? |
取足量小纸袋中固体放入烧杯中,加入适量水,触摸杯壁。 |
|
不能作 干燥剂 |
| 问题3:我猜想变质后的物质可能是碳酸钙,该如何验证我的猜想? |
|
|
该干燥剂样品中有碳酸钙 |
(3)问题4:样品中碳酸钙的含量如何?某同学按如下流程进行实验:用盐酸溶解该干燥剂样品→干燥所得气体→用NaOH溶液吸收气体→根据NaOH溶液的增重计算该样品的含量,实验过程中所取该干燥剂样品的质量为10.0g。
实验装置如图所示: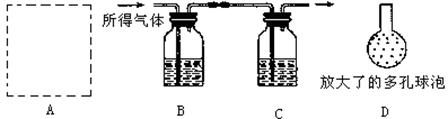 .
.
①A为溶解该干燥剂样品的装置,若已准备了长颈漏斗、双孔橡胶塞、导气管,为完成溶解至少还需要的实验仪器是 。
②A中发生反应的化学方程式为
③将插入溶液C中管子的下端改成具有多孔的球泡(如图中的D),有利于提高实验的准确度,其理由是 。
④当改进实验装置并进行正确操作后可以准确测定出干燥剂样品的含量(假设生成气体没有损失,并完全吸收)。若此时C装置在实验前后其质量增加了3.6g,则该干燥剂样品的含量为 %。
⑴实验操作中,不慎将手指划破,这时可从急救箱中取FeCl3溶液止血,其原理是。
⑵今有两瓶标签模糊不清,只知道分别盛有淀粉溶液和氯化钠溶液,试用多种方法对其鉴别。(写出其中2种方法,每种2分)
①。
② 。
。
医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 
(1)CaCO3与盐酸反应的离子方程式。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有。滤渣主要成分的化学式。
(3)酸化时加盐酸的目的为:
①,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃:。
结晶要保持在160℃:。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、NO3-、SO42-、Cl-、HCO3-、Cu2+,取该溶液实验如下:
①取少量该溶液,加几滴石蕊试液, 溶液变红色
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热, 有无色气体产生,后在空气中又变成红棕色
③取少量该溶液 ,加BaCl2溶液, 有白色沉淀生成
,加BaCl2溶液, 有白色沉淀生成
④取③中上层清液,加AgNO3溶
 液, 有白色沉淀生成,且不溶于HNO3
液, 有白色沉淀生成,且不溶于HNO3
⑤取少量该溶液,加NaOH溶液, 有白色沉淀生成,当NaOH过量时沉淀部分溶解
根据上述实验现象判断:
(1)溶液中肯定存在的离子是。
(2)溶液中肯定不存在的离子是。
(3)为进一步确定可能存在的离子,应该补充的实验是。
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为::;
为了吸收该反应中产生的尾气,请选择下列中合适的装置。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器X中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元 素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
请回答下列问题:
①方案1中的仪器X名称是。
②方案2为了使铁离子全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3E、Fe2(SO4)3 |
④方案2中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因
。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制 在50℃~60℃不宜过高的原因是
在50℃~60℃不宜过高的原因是
⑥本实验CuSO4·5H2O的产率为。
S2Cl2是一种易挥发的液体(熔点:—76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置 (夹持装置、加热装置均已略去)。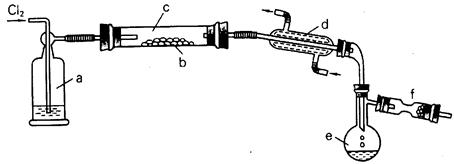
(1)已知S2Cl2分子结构与H2O2相似,则S2Cl2的分子中共含有条共价键。
(2)装置a中应放试剂为 ;装置d的名称是 ,它的作用是。
(3)该实验的操作顺序应为 (用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2⑤停止加热装置c
(4)图中f装置中应放置的试剂为 ,其作用为。
(5)将S2Cl2的水解气体产物通入氯水中,若观察到的现象,则可证明水解产物中有硫化氢生成。