实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: : ;
为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器X中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元 素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知: Ksp[Fe((OH)3]≈10-38)然后过滤、浓缩、结晶。
请回答下列问题:
①方案1中的仪器X名称是 。
②方案2为了使铁离子全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3E、Fe2(SO4)3 |
④方案2中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因
。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
请回答下列问题:
⑤反应时温度控制 在50℃~60℃不宜过高的原因是
在50℃~60℃不宜过高的原因是
⑥本实验CuSO4·5H2O的产率为 。
(18分)某实验探究小组为了验证红热的炭与浓硫酸发生反应所生成的各种产物,设计了一个实验流程,其装置图如下。
(1)①中反应的化学方程式为。
(2)②处的现象是。
(3)品红溶液使用了两次,③的作用是,
⑤的作用是。
(4)④的作用是;反应的化学方程式为。
(5)根据现象可证明产物中一定有CO2气体。
(6)同学甲认为撤去装置⑤也可以确定CO2的存在,他所根据的实验现象是。
(7)同学乙认为④中的溶液挥发出有毒的Br2蒸气,建议换成另外一种中学常见的有色溶液更安全,这种溶液是。
(11分)三颈瓶在化学实验中的应用非常广泛,下面是三颈瓶在部分无机实验或有机实验中的一些应用。
(1)在如图所示装置中,进行氨的催化氧化实验:向三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶子并接近液面。反应过程中可观察到瓶中有红棕色气体产生,铂丝始终保持红热。实验过程中 的电离程度____(填“变大”、“变小”或“不变”)
的电离程度____(填“变大”、“变小”或“不变”)
(2)实验室用下图所示装置制备氨基甲酸铵(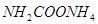 ),其反应化学方程式:
),其反应化学方程式:
该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
①写出加入药品之前实验操作的要点_______;反应中若有水存在则生成碳酸氢铵的化学方程式是________________________。
②干燥管中盛放的药品是______。简述左侧三颈瓶装置制取氨气的原理________。
③对比碳酸盐和酸的反应制取 ,该实验利用干冰升华产生
,该实验利用干冰升华产生 气体的有优点有_____.
气体的有优点有_____.
④有同学认为该实验装置存在安全问题,请问可能面临的安全问题是________。
⑤氨基甲酸氨可用作肥料,其肥效比尿素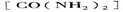 _______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
_______(填“高”或“低”),在潮湿的空气中释放出氨而变成碳酸氢铵。取因部分变质二混有碳酸氢铵的氨基甲酸铵样品0.7830g,用足量石灰水充分处理后,使样品中碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g,则样品中氨基甲酸铵的物质的量分数是_____________。
【改编】(15分)一种广泛用作药剂、有机氯化剂,及用于制造染料、橡胶的化工原料——硫酰氯(SO2Cl2),常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气。氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如下:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3kJ·mol-1
SO2Cl2(l) △H=-97.3kJ·mol-1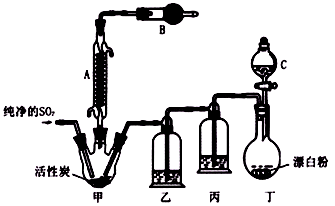
(1)仪器A的名称是 ;甲中活性炭的作用是__ ____。
(2)干燥管B中盛放的药品是 。
(3)实验时从仪器C中放出液体的操作方法是 。
(4)装置乙中盛放的物质为 ,若缺少装置乙,对实验结果有什么影响? 。
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯, 同时还有另外一种物质生成,该反应的化学方程式为 ,分离的产物的方法是 。
A.重结晶B.过滤 C.蒸馏D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。
A.控制气流速度,宜慢不宜快
B.水浴加热三颈烧瓶
C.若三颈烧瓶发烫,可适当降温
(15分)氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K;
(2)废铁屑中的杂质不与盐酸反应;
(3)不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
20 |
80 |
100 |
| 溶解度(g/100 g H2O) |
74.4 |
91.8 |
525.8 |
535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.……,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是 。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“……”的内容是 。
(3)从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入 后、 _ 、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式 。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为 。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol•L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2 + 2S2O32- ═ 2I- + S4O62-)。
①滴定终点的现象是 _ 。
②样品中氯化铁的质量分数 _ 。
【原创】(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:
相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑
[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
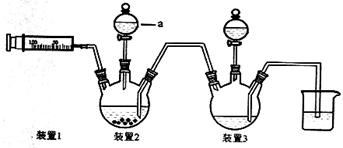
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
【命题立意】本题基于实验室制备二氯化一氯五氨合钴,融入工艺流程、实验原理分析、实验基本操作、条件控制、产率计算等内容,旨在考查考生知识迁移能力、综合实验能力和实验探究能力。