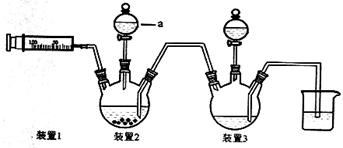
【原创】(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:

相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑
[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
【命题立意】本题基于实验室制备二氯化一氯五氨合钴,融入工艺流程、实验原理分析、实验基本操作、条件控制、产率计算等内容,旨在考查考生知识迁移能力、综合实验能力和实验探究能力。
如图是一个制取氯气并以氯气为原料进行特定反应的装置。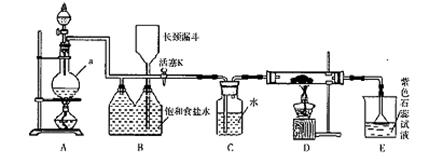
(l)A是氯气发生装置,写出其中的化学反应方程式。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式,装置C的作用是。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B
中的现象是;若发现装置B中该现象不明显,可能的原因是;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式。
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持______________条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是_____________;应该测定的实验数据是____________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是______
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(15分)S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图:
| 物质 |
沸点/℃ |
熔点/℃ |
| S |
445 |
113 |
| CS2 |
47 |
-109 |
| CCl4 |
77 |
-23 |
| S2Cl2 |
137 |
-77 |
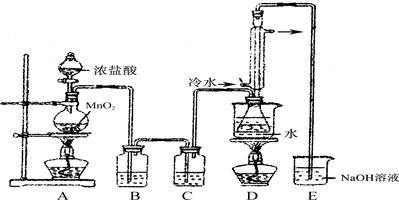
(1) 利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是________(填写以上两种反应原理的数字序号)。
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是________。
(3)D装置中冷凝管的作用是________________;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是________。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为____________________。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和________。
(6)上图尾部装置不够完善,存在的问题是____________。
(12分)NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收,得到NaNO2、NaNO3和Na2CO3的混合液及CO2气体。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0 t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1)第一步生产过程中发生反应的总化学方程式是____。
(2)检验NaNO3成品中是否含少量的Na2CO3杂质的方法是____。
(3)生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4)生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积至少为________m3(标准状况下)。
某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。
经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2的混合液(常用于实验室制N2),干燥管B、G中装有碱石灰,试管D、F、I中盛有澄清石灰水。
(1)连接好装置后,加入药品前,应该进行的实验操作是____________________(填操作名称)。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________________;然后停止加热,关闭活塞a,实验结束前,还要打开活塞a,加热烧瓶A一段时间,其目的是_。
Ⅰ.定性研究:
(3)试管D中出现浑浊,证明产物中有____________存在,证明分解产物中存在CO的现象是________,要证明分解时产生的另一种气态产物的存在应该如何改进装置___________;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为。
Ⅱ.定量分析(假定每一步反应进行完全):
(4)取7.2 g样品进行实验,测得硬质玻璃管C中残余固体2.88 g,硬质玻璃管H中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的化学方程式为:。