仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: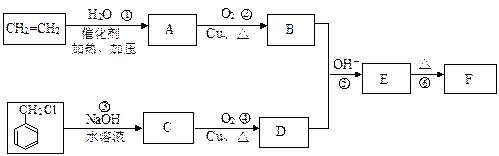
已知:反应⑤为加成反应。请回答:
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)反应①~⑥中符合原子经济性的是 。
(3)写出下列转化的化学方程式:
② ,
③ 。
写出有关反应的类型:② ⑥ 。
(4)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中
有一个甲基在对 位且属于酯类)。
位且属于酯类)。
(1)过氧化钠可用作于制氧剂,写出过氧化钠与二氧化碳反应的化学方程式
(2)铁与高温水蒸气反应:
(3)碳酸钠与稀盐酸反应:
新切开的金属钠,切面呈________色,在空气中很快变暗,有关的化学方程式是________.将小块金属钠投入盛有水的烧杯里,钠熔化成闪亮的小球,说明________.向烧杯中滴加酚酞试液,溶液呈______色,说明 ________,反应的化学方程式为________
________,反应的化学方程式为________
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的Na OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
OH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)原NaO H溶液的质量分数为________。
H溶液的质量分数为________。
(2)所得溶液中Cl-的物质的量为________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为黄色,E溶液是无色的,请回答:
(1)D的化学式是是________,画出B元素原子结构示意图__________。
(2)反应④的化学方程式为____________________。
(3)现有12mol/L的E溶液, 要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。
要稀释为0.15mol/L的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管、还需要_________________。量取浓溶液的体积是______mL。在配置过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”,下同),如果实验完毕忘记洗涤量筒会造成所配溶液浓度_______。
有一包白色固体,可能含有Na2CO3、KNO3、NaCl、BaCl2和CuSO4,按下列步骤做实验。
①将该固体溶于水只得到无色溶液。②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。
根据上述现象判断:(1)一定存在的物质是____________,一定不存在的物质是____________。(2)可能存在的物质是____________,可以采用__________实验确定其存在。