有一包白色固体,可能含有Na2CO3、KNO3、NaCl、BaCl2和CuSO4,按下列步骤做实验。
①将该固体溶于水只得到无色溶液。②向溶液中加入AgNO3溶液,得到白色沉淀,再加稀HNO3,白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。
根据上述现象判断:(1)一定存在的物质是____________,一定不存在的物质是____________。(2)可能存在的物质是____________,可以采用__________实验确定其存在。
某氮肥厂氨氮废水中的氮元素多以NH 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
(2)过程Ⅱ:在微生物作用下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: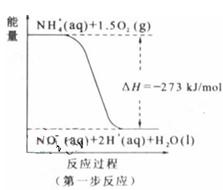

①第一步反应是 反应(选填“放热”或“吸热”),判断 依据是 。
依据是 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是 。
(aq)的热化学方程式是 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反 应的还原剂和氧化剂的物质的量之比是 。
应的还原剂和氧化剂的物质的量之比是 。
Fe(OH)2在空气中极易被氧化,而使实验室制取存在一定困难,人们尝试用多种方法来制得白色的Fe(OH)2沉淀。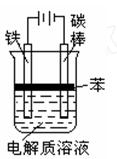

(1)方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①配制FeSO4溶液时,在蒸馏水中加入硫酸亚铁晶体外还需加入。
②除去蒸馏水中溶解的O2常采用的方法。
(2)方法二:用电解法制Fe(OH)2,实验装置如上左图所示。
①电解时,电解质溶液应选用下列试剂中的(填编号字母)
| A.氯化钠溶液 | B.稀硫酸 | C.硫酸铜溶液 | D.碳酸钠溶液 |
②电解时阴极的电极反应为: 。
。
③电解质溶液液面复盖一层苯所起的作用是。
(3)方法三:在如上图右装置,先打开止水夹,反应一段时间后关闭止水夹, 右侧试管内可见到白色沉淀。
右侧试管内可见到白色沉淀。
①该法可使沉淀的白色维持较长时间,其原因是。
②该法操作不当,在右侧试管中得不到沉淀,其原因是。
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是,电极名称是,N的电极反应式为,加入乙醇的铂电极的电极反应式。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为。
(1)洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体: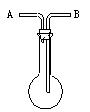
①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥CO2、⑦O2、⑧SO2、⑨C2H4
(A)若烧瓶是干燥的,把装置颠倒放置由B口进气,可收集的气体有_______
(B)若在烧瓶内充满水,可收集的气体有________,气体应由____口进入
(2)下列实验能达到实验目的且符合安全要求的是。
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是;X与氢元素形成的化合物的电子式是.
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是;写出D与E形成分子的电子式;D所在族元素的氢化物中,沸点最低的是.
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为.