某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是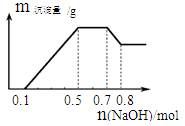
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |
由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种或两种以上元素,它们分子中质子总数均与氩原子的质子数相同,已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是:
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第2周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲含有相同元素,且该元素在二者中的百分含量相同,则丁中一定含有-l价元素 |
同时加热氯化镁晶体(MgCl2·6H2O)和硫酸镁晶体(MgSO4·7H2O)时,氯化镁易发生水解反应,其原因是:
| A.氯化镁水解是熵增反应 | B.硫酸镁晶体分解反应是放热反应 |
| C.硫酸镁晶体分解反应是熵减反应 | D.氯化镁分解放热比硫酸镁少 |
下列解释实验现象的反应方程式正确的是:
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2 = Na2O2 |
| B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgC1+S2-= Ag2S +2C1- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2 + CO2= 2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: |
2HCO3-+Ca2++2OH- = CaCO3↓+CO32-+2H2O
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是: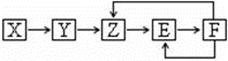
| A.X可能是一种氢化物 |
| B.若Y为单质,Y生成Z属于化合反应 |
| C.E可能是一种有色气体 |
| D.F中M元素的化合价可能为+5 |
工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若有标准状况下 VL 氨气完全反应,并转移 n 个电子,则阿伏加德罗常数(NA)可表示为:
| A. 11.2n/5V | B. 5V/11.2n | C. 22.4V/5n | D. 22.4n/5v |