某无色溶液,仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵ 在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
A.SO42-、AlO2─、Na+、CO 32─ 32─ |
B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO 4─、Na+、CO32─[ 4─、Na+、CO32─[ |
如图是制取和收集某气体的实验装置,该装置可用于()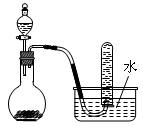
| A.二氧化锰固体和双氧水反应制取O2 |
| B.浓氨水和生石灰反应制取NH3 |
| C.浓硝酸与铜反应制取NO2 |
| D.浓盐酸和二氧化锰反应制取Cl2 |
下列说法错误的是()
| A.化学反应实质是旧键断裂和新键形成 |
| B.极性键就是共用电子对发生偏移的共价键 |
| C.氢键是一种比较弱的化学键 |
| D.水结冰时体积膨胀、密度减小就是因为氢键的存在 |
在一定条件下,反应N2+3H2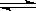 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
| A.V(NH3)=0.02mol/(L·min) | B.V(N2)=0.005mol/(L·min) |
| C.V(NH3)=0.17mol/(L·min) | D.V(H2)=0.03mol/(L·min) |
等质量的下列烃完全燃烧,消耗氧气最多的是()
| A.CH4 | B.C2H4 | C.C4H8 | D.C6H6 |
用于制造隐形飞机的某物质具有吸收微波的功能,其主要成分的结构如图,它属于()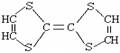
| A.无机物 | B.烃 | C.高分子化合物 | D.有机物 |