氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.以上说法都不正确。 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(s)+2B(g)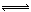 4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
| A.前2min,D的平均反应速率为0.2mol·L-1·min-1。 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
下列说法正确的是
| A.0.l mol·L-l的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| D.VlLpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
下列说法正确的是
| A.同周期的IIA族与ⅢA族元素的原子序数一定相差1 |
| B.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C.元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
| D.镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素 |
下列各组离子能够大量共存的是
| A.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B.水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、HC03-、Cl-、S2- |
| C.使pH试纸显蓝色的溶液中:Cu2+、Fe3+、N03-、SO42- |
| D.在A1C13溶液中:Na+、[Al(OH)4]-、SO42-、N03- |
下列离子方程式书写正确的是
| A.氯气溶于水:Cl2+H20=2H++C1-+C10- |
| B.硫酸铝溶液中加入足量氨水:Al3++40H-=[Al(OH)4]- |
| C.FeS04溶液与稀硝酸反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H20 |
| D.碳酸氢铵和足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O |