平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物)。②Al3+在pH=5.0时沉淀完全; Mg2+在p H=8.8时开始沉淀,在pH=11.4时沉淀完全。
H=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向一定量的X粉末中加入45.0mL的2mol/L盐酸溶液中,恰好完全反应并收集到112mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调 节pH至5~6,产生白色沉淀B,过滤。
节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。沉淀物进行洗涤干燥后重1.74g,
(1)A的电子式是 。
(2)由I可确定X中存在两种带负电荷的原子团及个数比
(3)由I判断X一定不含有的元素是 。
(4)Ⅲ中生成B的离子方程式是 。
(5)Ⅳ中B溶解的化学方程式是 。
(6)沉淀C的化学式是 。
(7)若X中n(B)∶n(C)=1∶3,则X的化学式是 。
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)A的化学式是______
(2)F在空气中转化为G的化学方程式:________________________
(3)C转化为I的离子方程式:__________________________
(4)J转化为C的化学方程式:________________________
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有离子,一定不含有离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是观察到的现象是 。
置换反应的通式可表示为: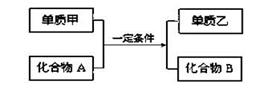
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若A为两种元素形成常温下呈液态的化合物,化合物B的焰色反应呈黄色,则该反应的化学方程式为:。
(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨。则该反应的化学方程式为:。
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式为:。
Ⅰ将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。
(1)生成的黑色物质是(填化学式)。
(2)“体积膨胀,并放出有刺激性气味的气体”,写出对应的化学方程式。
(3)在(2)的反应中,体现浓硫酸具有 (填序号)。
①酸性②吸水性③脱水性④强氧化性
Ⅱ向80mL浓硫酸中加入56g铜片,加热,至不再反应为止。
(1)写出铜与浓硫酸反应的化学方程式。
(2)实验测得反应中共有13.44L SO2(标准状况)生成,反应中转移的电子有mol。
围绕下列七种物质:①铝、②A12O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦A12(SO4)3,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是 (填序号)。
(2)属于电解质的是(填序号)。
(3)写出最适宜制取Al(OH)3的离子方程式: 。
(4)两物质间发生反应的离子方程式为H++OH-= H2O,请写出该反应的化学方程式:。
(5)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为 。