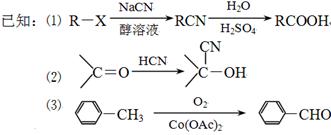
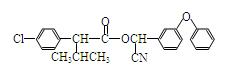
现用如下方法合成高效、低毒农药杀灭菊酯( ) :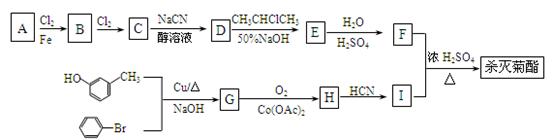
(1)F分子式为_____________________;合成G的反应类型是______________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A是苯的最简单的同系物
b.A的核磁共振氢谱有5个峰
c.燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应B→C的化学方程式(注明反应条件):_________________________。
(4)写出C在足量的氢氧化钠水溶液条件下发生充分反应的化学方程式:__________________
(5)D在硫酸存在下发生水解生成J:D 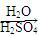 J
J
写出符合下列要求的J的所有同分异构体的结构简式(可以不填满):
________、________、________、_________、__________。
①苯环上有两个位于间位的取代基;
②能水解成两种有机物。
(6)α-氨基酸X与I互为同分异构体,且X是萘(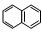 )的一取代物,含有碳碳叁键。写出由X通过肽键连接而成的高聚物Y的结构简式是 。
)的一取代物,含有碳碳叁键。写出由X通过肽键连接而成的高聚物Y的结构简式是 。
现有五种可溶性物质A、B、C、D、E,它们所含阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3—、CO32—、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________(填化学式)。
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记为C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀,向该沉淀中滴入稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为________。
A.SO32— B.SO42— C.CH3COO- D.SiO32—
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的________(填相应的离子符号)。有关反应的离子方程式为_________________________________________________________。
(4)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论:______________________________________。
某厂的酸性工业废水中含有一定量的Na+、Al3+、 Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为_______________________________________。
(4)步骤3反应的离子方程式为_______________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为__________________________________________________________。
工业上用含锌物料(含FeO、CuO等杂质)可制得活性ZnO,流程如下:
(1)上述流程中,浸出用的是60%H2SO4(1.5 g·cm-3),配制这种H2SO4 100 mL需要18.4 mol·L-1的浓H2SO4________ mL(保留一位小数)。
(2)加入氧化剂H2O2后,有Fe(OH)3沉淀出现,没有Cu(OH)2沉淀出现,若溶液中c(Fe3+)=2.6×10-18 mol·L-1,则溶液中c(Cu2+)的取值范围是________mol·L-1。(已知Ksp[Fe(OH)3]=2.6×10-39,
Ksp[Cu(OH)2]=2.2×10-20)
(3)加入NH4HCO3后生成的沉淀是形态均为Zna(OH)b(CO3)c(a、b、c为正整数)的两种碱式碳酸锌A和B的混合物,A中a=5、b=6,则生成碱式碳酸锌A的化学方程式为_______________________________________________。
(4)取洗涤、烘干后的碱式碳酸锌A和B的混合物49.70 g,其物质的量为0.10 mol,高温焙烧完全分解得到37.26 g ZnO、3.584 L CO2(标准状况下)和水,通过计算求出碱式碳酸锌B的化学式。
某同学购买了一瓶××牌“84消毒液”,查阅相关资料和消毒液包装说明得到如下信息:
“84消毒液”:含25%NaClO 1 000 mL、密度1.19 g·cm-3,稀释100倍(体积比)后使用。
请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________ mol·L-1。
(2)该同学取100 mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1(假设稀释后溶液密度为1.0 g·cm-3)。
(3)某实验需用480 mL含25%NaClO的消毒液。该同学参阅该“84消毒液”的配方,欲用NaClO固体配制该消毒液。
①下列说法正确的是________。
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
②在配制过程中,下列操作可能使配制的溶液的浓度偏大的是________。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量的浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为______________________________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。