锌与稀硝酸反应,若被氧化的锌与被还原的硝酸的物质的量之比为2:1,则该反应的还原产物为
| A.NO | B.N2O | C.NO2 | D.Zn(NO3)2 |
常温下,测得柠檬水溶液的pH是3,其中的c(OH-)是()mol/L:
| A.1x10-3 | B.0.1 | C.1x10-7 | D.1x10-11 |
吸热反应一定是①释放能量②吸收能量③反应物的总能量低于生成物的总能量④生成物的总能量低于反应物的总能量
| A.①③ | B.②③ | C.①④ | D.②④ |
已知热化学方程式:SO2(g)+ 1/2O2(g)  SO3(g)△H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)△H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是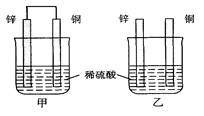
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
在pH =1的无色溶液中,能大量共存的是:
| A.Al3+、Na+、NO3-、Cl- | B.Cu2+、Na+、NO3-、Cl- |
| C.Ba2+、K+、CO32-、MnO4- | D.NH4+、H+、CH3COO-、 OH- |