常温时,浓度均为0.01mol/L的四种溶液:①Na2CO3溶液,②NaHCO3溶液,③H2CO3溶液,④CH3COOH溶液。下列有关说法不正确的是( )
| A.上述溶液中,将①和②等体积混合,其溶液中粒子浓度关系为 2c(Na+)=3c(HCO-3)+3c(CO2-3)+3c(H2CO3) |
| B.上述四种溶液中,由水电离的c(OH-)的大小关系为:①>②>④>③ |
| C.上述四种溶液中,分别加水稀释,所得溶液中c(H+).c(OH-)的数值不变 |
| D.上述四种溶液中,分别加入少量的NaOH固体,此时溶液的pH均增大 |
下列关于指定粒子构成的几种描述中不正确的是
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素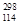 X与82Pb具有相同的最外层电子数 X与82Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
D.O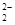 和S2-具有相同的质子数和电子数 和S2-具有相同的质子数和电子数 |
下列元素中,最高正化合价数值最大的是
| A.Na | B.P | C.C1 | D.C |
下列关于自然界中氮循环(如图)的说法不正确的是
| A.氮元素均被氧化 |
| B.工业合成氨属于人工固氮 |
| C.含氮无机物和含氮有机物可相互转化 |
| D.碳、氢、氧三种元素也参与了氮循环 |
下列我国古代的技术应用中,其工作原理不涉及化学反应的是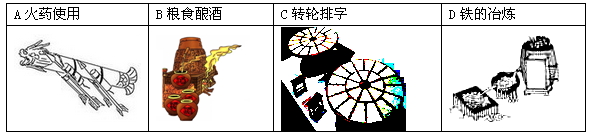
在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,反应停止后,滤液仍为蓝色,有关判断正确的是
| A.滤渣中一定有银,没有铜和锌 |
| B.滤渣中一定有银和锌,可能有铜 |
| C.滤液中一定有硝酸锌、硝酸铜、硝酸银 |
| D.滤液中一定有硝酸锌、硝酸铜,可能有硝酸银 |