在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)  zC(g) 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
zC(g) 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是
| A.x+y<z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.G的体积分数不变 |
中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)
A.cB=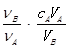 |
B.cB=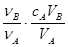 |
C.cB= |
D.cB=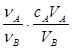 |
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中所有粒子的浓度都减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mL pH=11的NaOH溶液,混合液pH=7 |
在25℃时,用0.125 mol·L-1的标准盐酸溶液滴定25.00 mL未知浓度的NaOH溶液所得滴定曲线如图所示,图中K点代表的pH为
| A.13 | B.12 | C.10 | D.11 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
下列实验操作能达到测量要求的是
| A.用托盘天平称量25.21 g氯化钠 |
| B.用10 mL量筒量取7.50 mL稀硫酸 |
| C.用25 mL滴定管量取14.86 mL溶液 |
| D.用广泛pH试纸测得溶液的pH为4.2 |