几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
L |
M[ |
Q |
R |
T |
| 原子半径/nm[ |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
主要 化合价 化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
| A.R的氧化物对应的水化物可能具有两性 | B.L、Q形成的简单离子核外电子排布相同 |
| C.T、Q的氢化物的稳定性:Q>T | D.L、M的单质中金属键的强弱:L>M |
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.K2和K1的单位均为mol·L-1 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
将NO2装入带活塞的密闭容器中,当反应2NO2(g)  N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
| A.升高温度,气体颜色加深,则此反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
已知Na2S2O3+H2SO4═Na2SO4+SO2 +SO2
+SO2 +H2O下列各组实验中溶液最先变浑浊的是
+H2O下列各组实验中溶液最先变浑浊的是
| 组号 |
参加反应的物质k.Com] |
|||||
| 反应温度(℃) |
 |
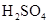 |
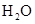 |
|||
| V(mL) |
C(mol/L) |
V(mL) |
C(mol/L) |
V(mL) |
||
| A |
10 |
5 |
0.1 |
5 |
0.1 |
5 |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.2 |
5 |
0.2 |
5 |
| D |
30 |
5 |
0.2 |
5 |
0.2 |
10 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③缩小反应容器容积压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
某温度下,C和H2O(g)在密闭容器中发生下列反应:
①C(s)+H2O(g)  CO(g)+H2(g);②CO(g)+H2O(g)
CO(g)+H2(g);②CO(g)+H2O(g)  CO2(g)+H2(g),当反应达到平衡时,测得c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1,则CO2的浓度为
CO2(g)+H2(g),当反应达到平衡时,测得c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1,则CO2的浓度为
| A.0.1 mol·L-1 | B.0.9 mol·L-1 |
| C.1.8 mol·L-1 | D.1.9 mol·L-1 |