下表是长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于 晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。
晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。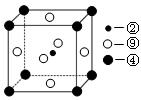
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石 油化工发展水平的标志。有关该氢化物分子的说法正确的是
油化工发展水平的标志。有关该氢化物分子的说法正确的是  。
。
a.分子中含有氢键 b.属于非极性分子
c.含有4个σ键和1个π键 d.该氢化物分子中,②原子采用sp2杂化
(4)某元素的外围电子排布式为nsnnpn+1,该元素可与①形成三角锥形的分子X, X在①与③形成的分子Y中的溶解度很大,其主要原因是
。
(5)将过量的X通入含有元素⑩的硫酸盐溶液中,现象是 ,反应的离子方程式_ 。
(6) ⑩单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.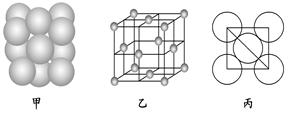
若已知⑩的原子半径为d,NA代表阿伏加德罗常数,⑩的相对原子质量为M,请回答:晶胞中⑩原子的配位数为________,该晶体的密度为___ _____(用字母表示)。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。
(1)含有较多的水称为硬水,硬水加热后产生沉淀的离子方程式为____________(写出生成一种沉淀物的即可)。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图: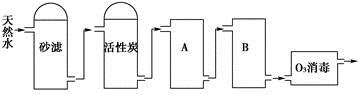
①活性炭的作用是____________;O3消毒的优点是___________。
②A、B中放置的物质名称分别是A_________;B__________。A、B中放置的物质是否可以互换?请说明原因__________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为。电渗析法净化水时, 使离子通过半透膜的推动力是。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的。
(5)某城市用水中,c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3-)为8.0×10-4mol/L。如用药剂软化该水1000L,应加入Ca(OH) 2g, Na2CO3__________ g
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: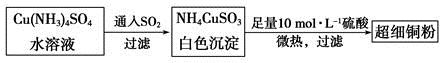
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为__________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_________;在该晶体中存在的化学键的种类有_________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。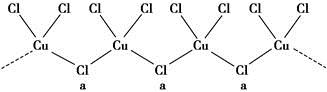
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.5]。
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
(1)B的名称为_____________,E中所含官能团的名称为;
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式高聚物P的亲水性比由E形成的聚合物_____(填“强、弱”)。
(5)D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有种。写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:

碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图: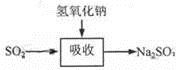
已知:
| 试剂 |
Ca(OH)2 |
NaOH |
| 价格(元/kg) |
0.36 |
2.9 |
| 吸收SO2的成本(元/mol) |
0.027 |
0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是。和碱法相比,石灰-石膏法的优点是,缺点是。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。
① Ni原子的价电子排布式是。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是,其中心原子N的杂化方式是。
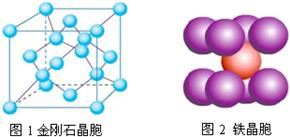
(4)在金刚石晶体的一个晶胞(如图1)中,含有个碳原子。在二氧化硅晶体的一个晶胞中,含有个化学键。原子晶体能否形成最密堆积结构,原因是。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是。