烧结法制氧化铝生产过程如下: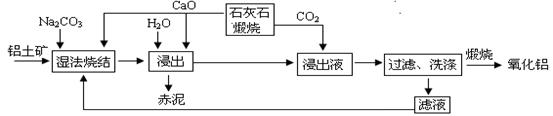
已知:①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。 ②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解化学反应方程式 ▲ 。
(2)浸出时再加入CaO的目的是 ▲ 。
(3)浸出液中发生的生成Al(OH)3的离子反应方程式 ▲ 。
(4)滤液的主要成分是 ▲ (写化学式);滤液循环使用的优点 ▲ 。(任答一点)
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(A) |
0.20 |
0.14 |
0.10 |
c |
d |
e |
| c(B) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
⑴m=,表中bc(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为(保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时。
①A的转化率越高②B的产量越大
③A与B的浓度之比越大④正反应进行的程度越大
下图表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是;bc过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c-d处。
2SO3(g),△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是;bc过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c-d处。
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
试回答下列问题
⑴上述正向反应是反应(填“放热”或“吸热”)。
⑵在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有(选填A、B、C、D、E)。
| n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
| E |
3 |
1 |
2 |
1 |
⑶已知在一定温度下:
C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g) CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2;
则K、K1、K2之间的关系是K=。
⑷若在500℃时进行,设起始时CO和H2O的起始浓度均为0.010mol/L,在该条件下,CO的平衡转化率为:。
⑸若反应在800℃进行,设起始时CO(g)和H2O(g)共为1mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=。
已知水在25℃和95℃时,其电离平衡曲线如右图所示: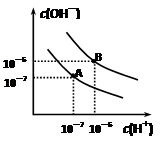
⑴则25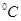 时水的电离平衡曲线应为(填“A”或“B”)。
时水的电离平衡曲线应为(填“A”或“B”)。
⑵25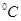 时,将
时,将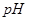 =8的NaOH溶液与
=8的NaOH溶液与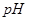 =5的
=5的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的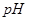 =7,则NaOH溶液与
=7,则NaOH溶液与 溶液的体积比为。
溶液的体积比为。
⑶95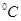 时,0.1 mol/L的NaOH溶液的pH值是。
时,0.1 mol/L的NaOH溶液的pH值是。
⑷95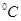 时,若100体积
时,若100体积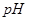 1=
1=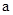 的某强酸溶液与1体积
的某强酸溶液与1体积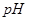 2=b的某强碱溶液混合后溶液呈中性,则混合前,
2=b的某强碱溶液混合后溶液呈中性,则混合前,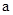 与b之间应满足的关系是
与b之间应满足的关系是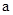 =(用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
=(用含b的代数式表示),a+b_______14(填“<”、“=”或“>”)。
将2 mol A和2 mol B充入某密闭容器中发生反应:2A(g)+B(g) xC(g) △H>0,达到化学平衡后,C的体积分数为a。
xC(g) △H>0,达到化学平衡后,C的体积分数为a。
⑴此反应的化学平衡常数是K=(用含x、c(A)、c(B)、c(C)的代数式表示)。
⑵假设该反应的条件分别和下列各选项的条件相同,选填“甲”、“乙”或“丙”:
甲.大于a乙.小于a丙.等于a
①若在恒温恒容下,当x = 1时,按1 mol B、l mol C作为起始物质,达到平衡后,C的体积分数为;
②若在恒温恒容下,当x = 3时,2 mol B、6 mol C作起始物质,达到平衡后,C的体积分数为;
③若在恒温恒压下,按3 mol A、3 mol B作起始物质,达到平衡后,C的体积分数为。