MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下: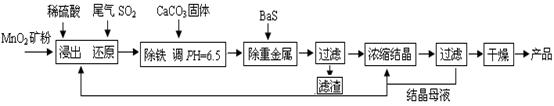
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 ▲ 。
(2)除铁发生的离子反应方程式为 ▲ 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= ▲ mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解 的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是 ▲
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 ▲ 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= ▲ 时锰、铬去除率最好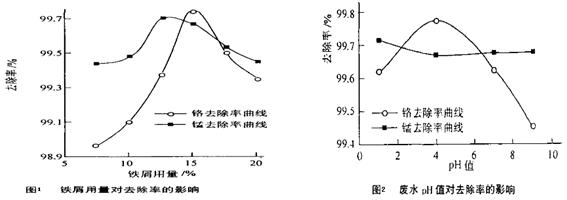
写出下列反应的化学方程式,注明反应类型:
(1)苯与浓硝酸、浓硫酸的混合物反应(60℃):___________________________________;
(2)甲苯制备 三硝基甲苯:_____________________________________________________;
三硝基甲苯:_____________________________________________________;
(3)乙烯与苯反应:__________________ ______________________________________;
______________________________________;
(4)丙烯与水反应生成醇(主要反应):__________________________________________;
反应类型依次是:____________________________________________________________。
(每空2分,共8分。)
1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
(1)写出反应④、⑦的化学方程式:
④______________________________________________________________;
⑦______________________________________________________________。
(2)上述七个反应中属于取代反应的有____________(填反应序号)。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为。
(每空2分,共10分。)
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。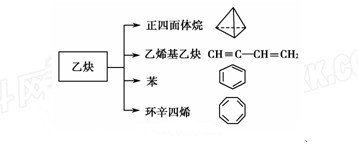
完成下列各题:
(1) 正四面体烷的二氯取代产物有________种。
正四面体烷的二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误 的是________。
的是________。
a.能使酸性KMnO4溶液褪色
b.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例)________________。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的物质发生加聚反应的反应方程式_______________。
(5)乙烯基乙炔可与HCl反应生成2-氯-1,3-丁二烯,写出2-氯-1,3-丁二烯加聚反应的反应方程式_______________。
(每空1分,共13分。)
(1)选择下列某种答案的序号,填入下表的空格。
①同位素②同素异形体③同分异构体④同系物⑤同种物质
| 物质 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
2-甲基戊烷与 |
| 名称 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2-二甲基丁烷 |
2,3-二甲基丁烷 |
| 相互关系 |
(2)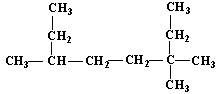 的名称为___________________________;
的名称为___________________________;
( 3)
3) 的名称为____________________________;
的名称为____________________________;
(4)2,4-二氯甲苯的结构简式为___________________________;
(5)反-2-戊烯的结 构简式为________________________________;
构简式为________________________________;
(6)某物质结构如图所示,其官能团是,;分子式为;
该物质可以与下列(填序号)发生反应。
A.酸性KMnO4溶液 B.氢气 C.溴水 D.NaOH溶液
B.氢气 C.溴水 D.NaOH溶液
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答: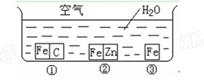
(1)铁被腐蚀的速率由快到慢的顺序是(填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮
B.海水中的轮船