根据下图回答以下问题: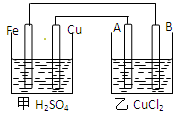
(A、B均为碳棒,两池中溶液均足量)
(1)甲装置是 池,乙装置是 池且Fe极为 极,A极为 极
(2)A极的电极反应
(3)若甲池中Fe溶解0.3 mol,则乙池中产生气体的总体积(标准状况)为 L,
乙池 极质量会增加 g
(10分)下表是元素周期表的一部分,请从表中所标明的十种元素中回答下列有关问题:

|
ⅠA |
ⅡA |
IIIA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 2 |
① |
② |
③ |
|||||||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最活泼的金属元素是______;在自然界中 形成的化合物种类最多(均填元素符号);
(2)表中有一种能形成两性氢氧化物的元素,写出该元素的单质与⑨元素最高价氧化物的水化物反应的离子方程式是__________________;
(3)④元素与⑦元素形成化合物的电子式__________________该化合物中所含化学键类型为__________________(填共价键或离子键)
(4)③、⑦、⑩元素中,阴离子还原性最强的是__________________(填离子符号)。
取标准状况下2.24L某气态烃置于密闭容器中,再通入足量的O2 ,用电火花引燃,燃烧产物的定量测定实验数据如下(图中的箭头表示气体的流向)。
通过计算回答:
(1)该烃的分子式___________________
(2) 写出可能的结构简式___________________ , ___________________ 。
A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示: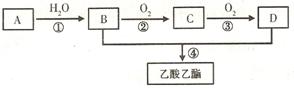
(1)A的结构式为_____________
(2)A—→B的反应类型为_____________________
(3)D的水溶液与氢氧化钠反应的离子方程式为________________________
(4)B与钠反应的化学方程式为__________________________
(5)反应③的化学反应方程式为:____________________
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3 _________ mol;
(2)O2的转化率为_____________;
(3)平衡时体系中SO2的百分含量(体积分数)为 __________;
(4)降低温度,O2的转化率____________;v正____________;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量__________。(填“增大”、“减小”或“不变”)
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 _,形成化学键要。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 __(填“放出”或“吸收”) ___kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧热的热化学方程式____________________________________。
(3)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲、乙两装置中,甲中负极电极反应式为_____________________,
溶液中的阳离子向_____极移动(填“正”或“负”);乙中铝电极作__________极,发生______反应(填“氧化”或“还原”)。