(10分)下表是元素周期表的一部分,请从表中所标明的十种元素中回答下列有关问题:

|
ⅠA |
ⅡA |
IIIA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 2 |
|
|
|
① |
② |
|
③ |
|
||||||
| 3 |
|
④ |
⑤ |
|
|
⑥ |
⑦ |
⑧ |
||||||
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)表中化学性质最活泼的金属元素是______;在自然界中 形成的化合物种类最多(均填元素符号);
(2)表中有一种能形成两性氢氧化物的元素,写出该元素的单质与⑨元素最高价氧化物的水化物反应的离子方程式是__________________;
(3)④元素与⑦元素形成化合物的电子式__________________该化合物中所含化学键类型为__________________(填共价键或离子键)
(4)③、⑦、⑩元素中,阴离子还原性最强的是__________________(填离子符号)。
已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为
;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为
;
理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
某溶液中含有Ba2+,Cu2+, Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右所示(写出最佳答案)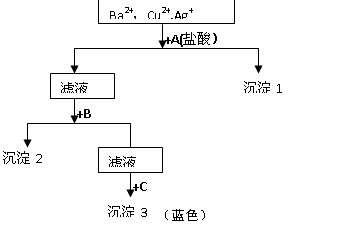
(1).写出沉淀的化学式:
沉淀1,沉淀2,沉淀3;
(2).写出混合液+A的离子方程式:。
滤液+B的离子方程式:。
在反应SO2 + Cl2 + 2H2O =" 2HCl" + H2SO4中,氧化剂是:______,
还原剂是:_______________,被氧化的物质是:________,发生还原反应的物质是:___________.当有1mol的HCl生成时,反应中转移的电子数是:__________mol,参加反应的SO2的质量_________克.
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的氧化产物为______________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: ________________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为。(假设溶液体积不变)
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系: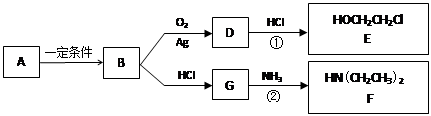
(1)B的电子式是。
(2)A可能属于下列哪类物质___________。
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): 化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)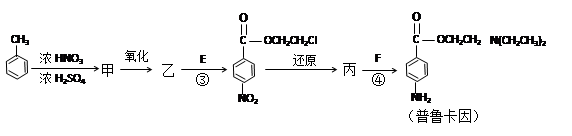
(甲苯)
(4)甲的结构简式是 _________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是:
(6)丙中官能团的名称是。
(7)已知RCOOR,+H2O→RCOOH+ R,OH叫做水解反应,普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
②D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是