PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加 溶液(c=0.1
溶液(c=0.1 /L)至PH=7,消耗
/L)至PH=7,消耗 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则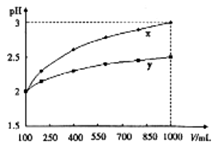
| A.x为弱酸Vx<Vy | B.x为强酸Vx>Vy | C.y为强酸Vx>Vy | D.y为弱酸Vx<Vy |
根据元素在周期表中的位置判断,下列元素中原子半径最小的是
| A.氧 | B.氟 | C.碳 | D.氮 |
下列装置或操作能达到实验目的的是()

(17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为:,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______ B_______ C _______ D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
已知某可逆反应:mA(g)+nB(g)  pC(g)△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g)△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
| A.T1<T2,p1>p2,m+n<p,△H>0 |
| B.T1>T2,p1<p2,m+n<p,△H<0 |
| C.T1>T2,p1<p2,m+n>p,△H>0 |
| D.T1>T2,p1>p2,m+n>p,△H<0 |
下列说法中正确的是
| A.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| B.CO2、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| C.具有共价键的晶体叫做原子晶体,一定具有高的熔、沸点及硬度 |
| D.H—F的键能为568 kJ/mol,H—Cl的键能为431.8 kJ/mol,这可以说明HF分子比HCl分子稳定 |