有机化学反应因反应条件不同,可生成不同的有机产品。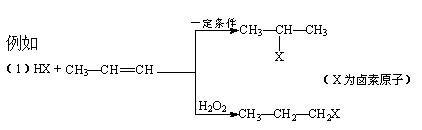
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用
下,苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成结构简式为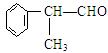 的物质,该物质是一种香料。
的物质,该物质是一种香料。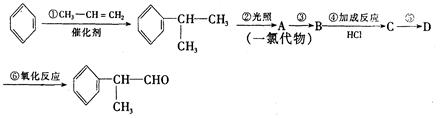
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应③、⑤的反应类型分别为___________________、___________.。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇F eCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):________________________________________________________
eCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):________________________________________________________
Fe(OH)2在空气中极易被氧化,而使实验室制取存在一定困难,人们尝试用多种方法来制得白色的Fe(OH)2沉淀。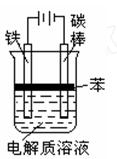

(1)方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①配制FeSO4溶液时,在蒸馏水中加入硫酸亚铁晶体外还需加入。
②除去蒸馏水中溶解的O2常采用的方法。
(2)方法二:用电解法制Fe(OH)2,实验装置如上左图所示。
①电解时,电解质溶液应选用下列试剂中的(填编号字母)
| A.氯化钠溶液 | B.稀硫酸 | C.硫酸铜溶液 | D.碳酸钠溶液 |
②电解时阴极的电极反应为: 。
。
③电解质溶液液面复盖一层苯所起的作用是。
(3)方法三:在如上图右装置,先打开止水夹,反应一段时间后关闭止水夹, 右侧试管内可见到白色沉淀。
右侧试管内可见到白色沉淀。
①该法可使沉淀的白色维持较长时间,其原因是。
②该法操作不当,在右侧试管中得不到沉淀,其原因是。
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是,电极名称是,N的电极反应式为,加入乙醇的铂电极的电极反应式。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为。
(1)洗气瓶用途的延伸:利用如图所示的装置收集以下8种气体: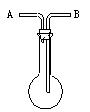
①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥CO2、⑦O2、⑧SO2、⑨C2H4
(A)若烧瓶是干燥的,把装置颠倒放置由B口进气,可收集的气体有_______
(B)若在烧瓶内充满水,可收集的气体有________,气体应由____口进入
(2)下列实验能达到实验目的且符合安全要求的是。
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是;X与氢元素形成的化合物的电子式是.
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是;写出D与E形成分子的电子式;D所在族元素的氢化物中,沸点最低的是.
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为.
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。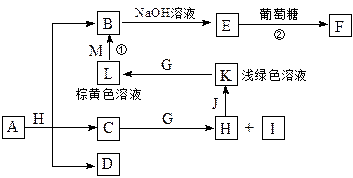
请回答下列问题:
(1)写出A的化学式______________,C的电子式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
_______________________________________________。
(4)研究表明:气体D在一定条件下可被 还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____、______、_______。
还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____、______、_______。