已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):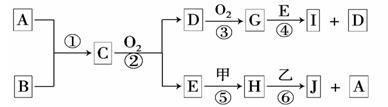
⑴写出反应②的化学方程式 。
⑵反应④中每消耗1 mol G,转移电子的物质的量为 。
⑶反应⑥的离子方程式是 。
⑷写出工业冶炼金属乙的化学方程式 。
⑸实验室中保存I的方法是 。
⑹SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混入O2,可能引起的后果是 。
下表为元素周期表的一部分,根据表中所列出的元素回答下列问题
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
F |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
Ar |
(1)最不活泼的元素是(填元素符号,下同),最活泼的非金属元素是
(2)可做半导体材料的元素是(填元素名称)
(3)氧离子结构示意图为,C、N、O原子半径从大到小的顺序是
(4)与水反应最剧烈的金属单质是,其反应的化学方程式是
(5)既能与强酸又能与强碱反应的金属单质是
(6)最高价氧化物的水化物中酸性最强的酸是(写化学式)
(7)气态氢化物的稳定性:H2SHCl(填“>”、“=”或“<”);
(8)Al2O3中铝元素与氧元素的质量比是,氧元素质量分数为
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象: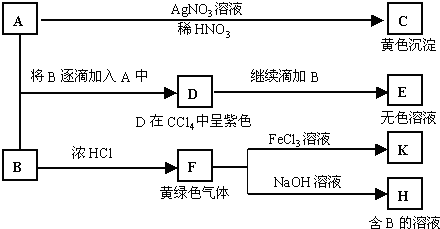
请回答:
(1)写出A和C的化学式:AC 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
_________________________________、___________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_____________________________。
(4)写出由F→H的化学方程式:__________________________________________。
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
(2)反应中,被还原的元素是_______,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。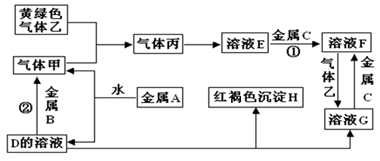
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______________;H ___________;G________;乙__________;
(2)写出下列反应的化学方程式
反应①____________________________________________。
反应②____________________________________________。
铁屑可用于地下水脱氮,其实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5 mol/L盐酸中进行预处理。
Ⅱ、30 min后,用去离子水反复冲洗,至冲洗后液体的pH为中性。在N2保护下烘干备用。
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液。
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中。
请回答:
(1)盐酸溶解Fe2O3的离子方程式是。
(2)烘干时需要在N2保护下进行的原因是。
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是。
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整: