完成下列各题:
⑴K2Cr2O7(橙色)、Cr2(SO4)3(绿色)、K2SO4、H2SO4、C2H5OH、CH3COOH和H2O分别属于同一氧化还原反应中的反应物和生成物,该反应原理可以用于检查司机是否酒后开车。
①若司机酒后开车,检测仪器内物质显示出 色。
②写出并配平该反应的化学方程式: 。
③如果在反应中生成1mol氧化产物,转移的电子总数为 。
⑵在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+ O2(g)="2NO(g) " △H=+180. 5 kJ/mol
5 kJ/mol
2C(s)+ O2(g)="2CO(g) " △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H = 。
②为了提高尾气转化的反应的速率和NO的转化率,采取的正确措施为 。
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 | D.降低温度同时增大压强 |
③该反应达到平衡时若增大压强,则混合气体的平均相对分子质量 ,若升高温度,则该反应的平衡常数 (均填“增大”、“减小”或“不变”)。
⑶已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断:①(NH4)2CO3溶液的pH 7(填<、>、=)。
②相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为  。(填序号)
。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
水是组成生命体的重要化学物质,有关水的反应实例有很多:
(1)有人设想将太阳能转化为电能,进而将水电解生成H2,H2是一种清洁能源。请分析电解水过程中,水(填“仅被氧化”“仅被还原”“既被氧化,又被还原”或“既未被氧化,又未被还原”,下同)。
(2)野营爱好者携带氢化钙固体作为生氢剂,反应方程式为:CaH2+2H2O Ca(OH)2+2H2↑,其中水。
Ca(OH)2+2H2↑,其中水。
硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO ,HSO
,HSO 在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO
在较稀(如1 mol·L-1以下)的溶液中,可完全电离为H+和SO 。不过,在浓度大的溶液中HSO
。不过,在浓度大的溶液中HSO 不能完全电离,而是与H+、SO
不能完全电离,而是与H+、SO 共同存在于同一溶液中。
共同存在于同一溶液中。
(1)硫酸氢钠(NaHSO4)所属的物质类别是()
| A.酸 | B.盐 | C.碱 | D.氧化物 |
(2)NaHSO4溶液的pH7。(填“>”“<”或“=”=
(3)在稀NaHSO4溶液中加入Na2CO3溶液时,可以得到无色、无味的气体,该气体可以使澄清石灰水变浑浊。写出稀NaHSO4溶液与Na2CO3溶液反应的化学方程式和离子方程式。
(已知锌与铝具有一定的相似性,如都能在强碱性溶液中形成酸根阴离子。实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到有大量气体冒出,后来放出气体速率变慢,至不再放出气体。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加强热至质量不变,最后得到1.20 g红色粉末。
(1)白铁镀锌的作用是______________;盖玻璃片的作用是____________。
(2)放出气体速率由快变慢的原因是_______________________________________。
(3)为什么要加入过量NaOH溶液__________________________________________。
(4)样品中锌的质量分数是_______________________________________________。
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。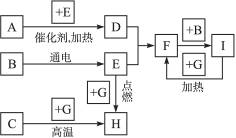
请按要求填空:
(1)写出下列物质的化学式:A______________,B____________,C____________。
(2)写出A→D的化学方程式________________________。
(3)写出G和I的浓溶液反应的化学方程式:________________________。
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、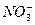 、
、 、
、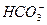 、Cl-等,取该溶液进行如下实验:
、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。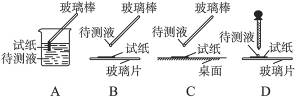
(2)根据上述实验判断原溶液中肯定存在的离子是______________________,肯定不存在的离子是___________________。
(3)写出与②和③两个实验有关的离子方程式:
②____________________________________________,
③____________________________________________。