 (1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g)
(1)一定条件下,在容积为2L的密闭容器中加入一定量的A,发生如下反应并建立平衡:A(g) 2B(g) 2B(g)
2B(g) 2B(g) 2D(g)+C(g)
2D(g)+C(g)
测得平衡时各物质的浓度是:c(A)="0.3" mol·L-1,c(B)="0.2" mol·L-1,c(C)="0.05" mol·L-1,则最初加入的A物质的量是( )
A.0.8 mol B.0.5 mol C.0.9 mol D.1.2 mol
(2)下图为10 mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示.请根据图示计算:
①氢氧化钠物质的量浓度是多少?__________
②A的pH值:__________
(3)已知硼(B)可形成化合物BCl3,该分子的所有原子最外层是否满足八电子稳定结构______(填“是”或“否”).BCl3在潮湿空气中会产生大量白雾,试写出其反应的化学方程式______________________________.
(4)已知锌锰干电池的总式为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+2H2O则该电池的正极反应式为___________________________.
下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
a |
c |
d |
e |
f |
g |
|
| 3 |
b |
h |
i |
j |
k |
(1)这些元素中非金属性最强的单质是 ,最高价氧化物对应水化物酸性最强的是 ,最高价氧化物对应水化物碱性最强的是 。
(2)表中k的氢化物的化学式为 ,它的还原性比j的氢化物还原性 (填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性 (填“强”或“弱”)。
(3)e单质为 ,其结构式为 。
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是 (填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
(10分)分子式为C2H6O的化合物A具有如下性质:
A+Na―→慢慢产生气泡
A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是()。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙酸 |
(2)含A的体积分数为75%的水溶液可以用作___________________
(3)A与钠反应的化学方程式:__________________
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为________。
(5)A可由含淀粉[(C6H10O5)n]的农产品如玉米、小麦、薯类等经发酵、蒸馏而得。请写出淀粉水解的化学方程式:__________________
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O
①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是 。
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H=—90.8 kJ·mol—1。
CH3OH(g) △H=—90.8 kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.CO的质量分数保持不变
d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH)
f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2
e.加入惰性气体
f.分离出甲醇
如图所示装置,回答下列问题: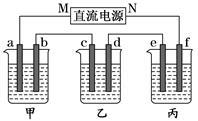
a、b、c、e、f均为石墨电极,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液和足量含有酚酞的K2SO4溶液.
(1)通电进行电解,发现丙中f极先变红色。
①直流电源的M极是 (填“正极”或“负极”)
②请写出甲池a 电极上的电极反应式:
③甲池电解过程中溶液的pH (填“增大”或“减小”),原因是:
④如果导线中通过4mol电子,则丙中溶液质量 (填“增大”或“减小”) g
(2)若用丙装置在铁上镀铜,需要将丙装置进行改装,则e应该是 (填“铁”或“铜”),电镀液是 溶液,电镀过程中电镀液的浓度 (填“增大”、“减小”或“不变”)。
(3)若用丙装置对铁的腐蚀进行防护, (填e或f)为铁电极,该防护方法称为__________。
硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_________,E的大小对该反应的反应热有无影响?___________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。