可以将氧化还原反应2H2+O2 2H2O设计成原电池。
2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通的气体应是 ,正极通的气体就是 ,电极反应为:正极 ,负极 。
(2)如果把KOH改为稀硫酸作电解质,则电极反应为:正极: ,负极: 。
(3)(1)和(2)的电解质溶液不同,反应进行后,其溶液的pH各有何变化? 。
(4)如把H2改为甲烷,KOH溶液作电解质溶液,则电极反应为:正极: ,负极: 。
完成下列各题:(1).在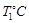 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);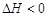 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为N2的转化率为
②在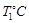 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为()(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为()(填选项字母)
a大于0.4mol b等于0.4mol c小于0.4mol
③下图是在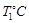 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在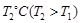 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。
(2).已知:Al3 +与HCO3–、CO32–、HS-、S2-等能发生彻底的
双水解,生活中通常利用Al3 +与HCO3–的反应来制作泡沫灭火器。泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考: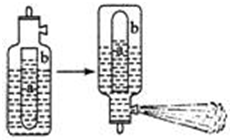
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为:。
②为了保证泡沫灭火器的使用寿命,通常在Al2(SO4)3溶液中加入另一种物质抑制硫酸铝的水解,请问该物质是。
③已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝能否发生彻底的双水解?如能,请写出该反应的离子反应方程式:。
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题: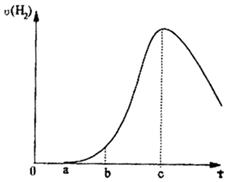
曲线由0→a段不产生氢气的原因____________________,
有关的离子方程式为___________________________;曲线由a→b段产生氢气的速率较慢的原因________________;
曲线由b→c段,产生氢气的速率增加较快的主要原因___________;
曲线由c以后,产生氢气的速率逐渐下降的主要原因____________。
根据提供条件推断元素,并按要求填空:原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为 ___________________________。
第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为______________,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为 _______________。
原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______、 ________、 ________、 ________ 。
某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式为 ________ 。
当一个化学反应中反应物总能量大于生成物总能量时,此反应为_______反应(吸热或放热),酸碱中和是____________反应(吸热或放热)。
氯原子的质量数为37,中子数为20,那么它的核外电子数是__________,质子数是__________。