工业上生产氯气,常在电解槽中电解饱和食盐水.
(1)写出该反应的离子方程式 ,电解槽中阳极材料应为 .为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.下图(左图)为电解槽的示意图。
(2)这种阳离子交换膜,只允许溶液中的 通过;(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
写出在电解过程中发生的电极方程式:阳极: ;
(3)若不用阳离子交换膜,电解产物之间发生的主要反应方程式为 。
(4)已知某电解槽每小时加入10%的氢氧化钠溶液l0kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 ;
(5)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇.
回答下列问题:
①写出在电解过程中发生的电极方程式:阴极: .
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码) ⑦滴定管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是____________。
(2)实验两次用到玻璃棒,其作用分别是:_____________、______________。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
有A、B、C、D、E5种元素,已知:
① A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
② 常温下B2是气体,它对氢气的相对密度是16。
③ C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④ D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1) A是________、B是________、C是________、D是________、E是________。(写元素符号)
(2) E的原子结构示意图为________________,C的离子结构示意图为________________。
(3) F和AB2反应的化学方程式为。
推断元素(以下各题所涉及的元素均在前20号)
①最外层有一个电子的元素是。
②最外层有两个电子的元素是。
③最外层电子数等于次外层电子数的元素是。
④最外层电子数等于次外层电子数两倍的元素是。
⑤最外层电子数等于次外层电子数三倍的元素是。
⑥最外层电子数等于次外层电子数四倍的元素是。
⑦电子层数与最外层电子数相等的元素是。
⑧电子层数为最外层电子数2倍的元素是。
⑨次外层电子数是最外层电子数2倍的元素是。
已知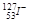 ,求它的Z、N、A、e分别是、、、。
,求它的Z、N、A、e分别是、、、。
根据下列叙述,写出元素名称并画出原子结构示意图。
①A元素原子核外M层电子数是L层电子数的一半。
②B元素原子的最外层电子数是次外层电子数的3/2倍。
③C元素的单质在常温下就能与水剧烈反应,产生的气体能使带火星的木条复燃。该反应的化学方程式为。
④D元素原子的次外层电子数是最外层电子数的1/4。